新型冠状病毒2019-nCoV/COVID-19研究进展(第9期)
来源:本站原创 2020-06-30 23:57
2020年6月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和
2020年6月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对近期2019-nCoV/COVID-19研究取得的进展进行一番梳理,以飨读者。
1.bioRxiv:解析包被SARS-CoV-2刺突蛋白的聚糖分子的结构 有望帮助开发新型候选疫苗
doi:10.1101/2020.03.26.010322
日前,一项刊登在预印版平台bioRxiv上的研究报告中,来自南安普敦大学等机构的科学家们通过研究揭示了引发COVID-19的冠状病毒SARS-CoV-2的基本特征,文章中,研究人员首次开发出了该病毒刺突蛋白的模型,同时揭示了病毒如何进行自我伪装在不被宿主发现的情况下进入宿主细胞,研究者希望以这种病毒蛋白为靶点来开发新型抗体和疫苗。
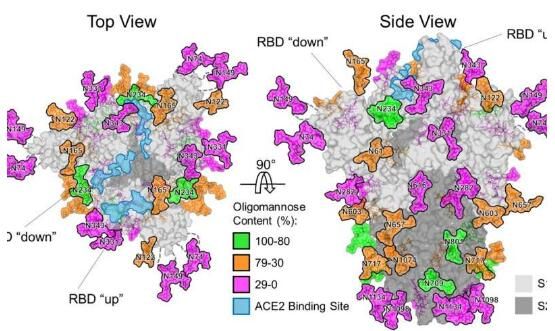
SARS-CoV-2表面有大量的刺突蛋白,其能吸附并进入人类宿主机体细胞,这些刺突表面被聚糖分子包括,其能伪装病毒蛋白并帮其躲避宿主免疫系统的监视,最终成功进入宿主细胞。这项研究中,研究人员利用先进的技术对覆盖在病毒刺突蛋白模拟物表面的聚糖分子的结构进行了相关研究;随后他们绘制出了这些聚糖分子的图谱,基于该图谱,研究人员就能阐明病毒蛋白表面如何与抗体进行结合,这对于疫苗设计至关重要。
研究者Crispin教授说道,通过给病毒刺突蛋白包裹聚糖分子,病毒就会像披着羊皮的狼一样,本文研究的一个重要发现是,不管病毒刺突蛋白上有多少糖分子,这种冠状病毒或许并不像其它病毒那样拥有高度的防护能力。诸如HIV等病毒会在宿主体内不断游荡,其必须不断躲避宿主的免疫系统监视,且拥有一层非常密集的聚糖来作为抵御宿主免疫系统的盾牌。但在SARS-CoV-2背景下,附着在病毒表面较低庇护能力的糖分子或许就反映出了该病毒是一种“打了就跑”的病毒,其会从一个人传播到另一个人身上,然而较低的聚糖浓度也意味着免疫系统使用抗体中和病毒的障碍更少一些,这对于后期疫苗的开发而言或许是一件非常重要的事情。
2.Cell子刊:开发出一种可用于对抗SARS-CoV-2/COVID-19的新系统
doi:10.1016/j.chom.2020.04.004
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国德克萨斯大学加尔维斯顿医学分部的研究人员在致力于抗击SARS-CoV-2的过程中开发出一种新的系统,它将使得科学家们更快地开发疫苗和评估开发中的疫苗、诊断感染者并探究这种冠状病毒如何进化。相关研究结果以论文手稿的形式在线发表在Cell Host & Microbe期刊上,论文标题为“An infectious cDNA clone of SARS-CoV-2”。
在德克萨斯大学加尔维斯顿医学分部人类遗传学教授Pei-Yong Shi博士的领导下,这些研究人员通过对一种反向遗传操作系统进行改造而开发出这种针对SARS-CoV-2的新系统。
反向遗传操作系统是研究和对抗病毒最有用的工具之一。这种系统允许科学家们在实验室中制造病毒,并在培养皿中操纵它。通过对这种系统进行改造,这些研究人员设计出了SARS-CoV-2病毒的一个改造版本,从而使得它被标记上霓虹绿(neon green)。当这种被标记的病毒感染细胞时,被感染的细胞会变成绿色。
3.Antivir Res:冠状病毒膜融合机制为抗病毒药物的开发提供了一种潜在的靶标
doi:10.1016/j.antiviral.2020.104792
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国康奈尔大学的研究人鉴定出COVID-19抗病毒治疗的一个潜在的靶标。相关研究结果于2020年4月6日在线发表在Antiviral Research期刊上,论文标题为“Coronavirus membrane fusion mechanism offers as a potential target for antiviral development”
这些研究人员起初着手分析了严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)的结构和特征,重点研究了刺突蛋白--特别是它的融合肽---如何让这两种冠状病毒通过转移它们的基因组来感染宿主细胞。随着当前的COVID-19疫情的不断加剧,他们将SARS-CoV和SARS-CoV-2的融合肽序列进行了比较,发现它们的序列匹配度高达93%。
康奈尔大学的Susan Daniel研究团队专门研究细胞膜的生物物理学特性;康奈尔大学的Gary Whittaker研究团队研究流感病毒和冠状病毒进入宿主细胞。Daniel团队和Whittaker团队组成的一个联合小组正在深入研究这种膜融合---冠状病毒传播机制的关键部分---的复杂过程。
4.mBio:开发针对SARS-CoV-2的疫苗有戏!低剂量PIV5疫苗鼻腔接种让小鼠免受致命剂量MERS-CoV感染
doi:10.1128/mBio.00554-20
在一项新的研究中,来自美国爱荷华大学和佐治亚大学的研究人员开发出了一种疫苗,可以完全保护小鼠免受致命剂量的MERS-CoV的伤害。这种疫苗利用一种无害的病毒将一种MERS-CoV蛋白递送到细胞内以产生免疫反应,这可能为开发针对包括COVID-19在内的其他冠状病毒病的疫苗提供了希望。相关研究结果于2020年4月7日在线发表在mBio期刊上,论文标题为“Single-Dose, Intranasal Immunization with Recombinant Parainfluenza Virus 5 Expressing Middle East Respiratory Syndrome Coronavirus (MERS-CoV) Spike Protein Protects Mice from Fatal MERS-CoV Infection”。论文通讯作者为爱荷华大学卡佛医学院的Paul McCray博士和佐治亚大学兽医学院的Biao He博士。
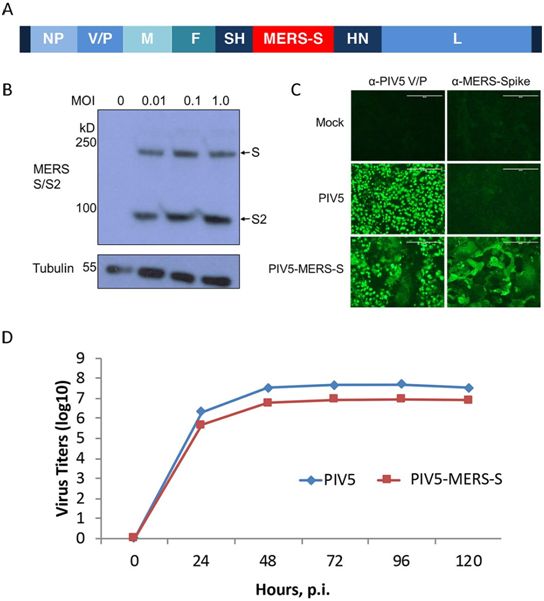
这些研究人员在一种经过基因改造后对MERS-CoV敏感的小鼠中测试了一种候选疫苗。这种疫苗是一种无害的携带MERS-CoV用来感染宿主细胞的刺突蛋白的副流感病毒(PIV5)。所有接种过这种疫苗的小鼠都在致命剂量的MERS-CoV攻击下存活了下来。
McCray说,“我们的新研究表明PIV5可能是一种针对新出现的冠状病毒病(包括COVID-19)的有用疫苗平台。通过使用同样的策略,基于表达SARS-CoV-2刺突蛋白的PIV5的候选疫苗已经产生了。我们正计划在动物中进行更多的研究,以测试基于PIV5的疫苗在预防SARS-CoV-2引起的疾病方面的能力。”
5.Nat Med:科学家们呼吁采取全球应对措施,保护COVID-19疫情大爆发期间最脆弱的人群
doi:10.1038/s41591-020-0851-2
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。2020年4月8日,一篇发表在Nature Medicine期刊上的标题为“COVID-19 in humanitarian settings and lessons learned from past epidemics”的评论性论文呼吁采取全球应对措施,保护COVID-19疫情大爆发期间最脆弱的人群。
这些作者指出,包括难民和移民在内的流离失所者往往首先受到污名化,并被不公正地归咎于导致疾病传播,但是在COVID-19疫情大爆发期间,他们也是最易受SARS-CoV-2病毒本身以及采取的控制它的措施影响的人群之一。
这篇论文借鉴了哥伦比亚大学梅尔曼公共卫生学院强迫移民与健康项目(Program on Forced Migration and Health)的工作人员在接受部署后目前实地从事人道主义响应和卫生系统加强工作过程中获得的集体实地经验。
6.PNAS:揭开COVID-19早期进化路径,或揭秘新冠病毒起源之谜!
doi:10.1073/pnas.2004999117
来自剑桥、英国和德国的研究人员利用基因网络技术,重建了COVID-19在人类身上的早期"进化路径"。通过分析第一批160个完整的病毒基因组,他们已经绘制出了一些新的冠状病毒通过其突变的原始传播,而这些突变产生了不同的病毒谱系。
研究人员使用的系统发育网络方法--允许在一个简单的图表中同时可视化数百棵进化树--这种方法于1979年在新西兰率先使用,然后在20世纪90年代由德国数学家开发。
剑桥大学的首席作者、遗传学家Peter Forster博士说:"有太多的快速突变,因此很难精确地追踪到一个COVID-19系谱树。我们使用数学网络算法来同时可视化所有可能的谱树。这些技术主要是通过DNA来绘制史前人类的运动轨迹。我们认为这是第一次使用它们来追踪像COVID-19这样的冠状病毒的感染途径。"
7.JVI:新研究表明小分子化合物EIDD-1931可抑制包括鼠肝炎病毒和MERS-CoV在内的一系列冠状病毒
doi:10.1128/JVI.01348-19
小分子胞苷类似物β-d-N4-羟胞苷(β-d-N4-Hydroxycytidine, NHC,也称为EIDD-1931,由美国埃默里大学药物开发研究所开发)最近已被证明可抑制多种病毒,包括基孔肯雅病毒、委内瑞拉马脑炎病毒(VEEV)、呼吸道合胞病毒(RSV)、丙型肝炎病毒(HCV)、诺如病毒、甲型流感病毒(IAV)、乙型流感病毒和埃博拉病毒。先前的报道显示了在治疗后病毒基因组中转换突变(transition mutation)的增加。人们还报道了EIDD-1931对人α冠状病毒HCoV-NL63和β冠状病毒SARS-CoV的抗病毒活性。迄今为止,科学家们尚未报道EIDD-1931抑制任何冠状病毒的作用机制,也未报道过冠状病毒对EIDD-1931的耐药性。
在一项新的研究中,来自美国范德堡大学医学院、埃默里大学和北卡罗来纳大学教堂山分校的研究人员研究了EIDD-1931对两种不同的β冠状病毒---鼠肝炎病毒(MHV)和MERS-CoV---的抑制作用以及这两种冠状病毒对EIDD-1931的耐药性。相关研究结果近期发表在Journal of Virology期刊上,论文标题为“Small-Molecule Antiviral β-d-N4-Hydroxycytidine Inhibits a Proofreading-Intact Coronavirus with a High Genetic Barrier to Resistance”。
他们发现EIDD-1931可强效抑制野生型鼠肝炎病毒(EC50=0.17 μM)和MERS-CoV(EC50 = 0.56 μM),而且它的细胞毒性很小。他们还证实鼠肝炎病毒的3'-5'核糖核酸外切酶的校对活性对EIDD-1931敏感性的影响有限,但可以测量到。
EIDD-1931对野生型鼠肝炎病毒和缺乏3'-5'核糖核酸外切酶活性的鼠肝炎病毒的抑制是相类似的,这表明它能够逃避或克服3'-5'核糖核酸外切酶活性的能力。仅在感染早期添加时,EIDD-1931才能够抑制鼠肝炎病毒、降低病毒的特异性感染能力和增加在单次感染后存在的G:A和C:U转换突变的数量和比例。
低水平的EIDD-1931耐药性难以实现,这与鼠肝炎病毒和MERS-CoV整个基因组中出现的多个转换突变有关。他们观察到EIDD-1931的抑制谱与以转换突变的积累为特征的诱变作用机制相一致,这表明耐药性的 遗传屏障很高。
8.NEJM:临床试验初步表明瑞德西韦可导致68%的重度COVID-19患者出现临床改善
doi:10.1056/NEJMoa2007016
瑞德西韦(remdesivir, 也称为GS-5734)是核苷酸类似物的前体药物(prodrug),它在细胞内代谢为抑制病毒RNA聚合酶的三磷酸腺苷类似物。瑞德西韦对包括线状病毒(比如埃博拉病毒)和冠状病毒(比如SARS-CoV和中东呼吸综合征冠状病毒[MERS-CoV])在内的几种病毒家族的成员具有广谱活性,并且已在非临床模型中对这些冠状病毒显示出预防性和治疗性的功效。体外测试还显示,瑞德西韦具有抗SARS-CoV-2的活性。根据包括健康志愿者和因急性埃博拉病毒感染而接受治疗的患者在内的大约500人的经验报告,瑞德西韦似乎具有良好的临床安全性。
在一项新的临床研究中,来自美国、日本、意大利、法国、加拿大、西班牙、荷兰和奥地利的研究人员描述了在同情使用的基础上接受瑞德西韦治疗重症COVID-19住院患者的临床结果。相关研究结果于2020年4月10日发表在NEJM期刊上,论文标题为“Compassionate Use of Remdesivir for Patients with Severe Covid-19”。
迄今为止,尚无疗法证明对COVID-19患者有效。这项初步的临床研究描述了一小群患有重度COVID-19并接受瑞德西韦治疗的患者的临床结果。尽管来自多个正在进行的随机对照临床试验的数据很快将提供有关瑞德西韦治疗COVID-19的安全性和有效性的更多信息,但是在这种同情使用方案中观察到的结果是目前可获得的最佳数据。具体而言,在68%的患者中观察到了氧气支持状态的改善,中位随访18天的总死亡率为13%。
对这项临床研究的结果的解释受限于患者队列的规模较小,随访时间相对较短,由于这种同情使用方案的性质而导致的潜在数据丢失,缺乏有关最初治疗的8例患者的信息以及缺乏随机对照组。尽管随机对照组的缺乏无法得出明确的结论,但是与文献中的同期队列(一般护理据预计与这项临床研究中的患者队列相一致)比较表明瑞德西韦在重度COVID-19患者中可能具有临床益处。但是,其他因素也可能导致结果差异,包括支持性治疗的类型(比如,伴随用药或通气方式的变化)以及机构治疗方案和住院门槛的差异。此外,使用有创通气作为疾病严重程度的一种指标可能会受到在特定位置呼吸机使用状况的影响。不过基于这些非对照数据的发现将会给正在进行的利用瑞德西韦治疗COVID-19的随机、安慰剂对照临床试验提供有用的信息。
9.Cell:新研究绘制出SARS-CoV-2的高分辨率基因图谱,并指出这种病毒的基因组仅由9个亚基因组RNA组成
doi:10.1016/j.cell.2020.04.011
在1977年,Jean Medawar和Peter Medawar写道,病毒“只是包裹在蛋白中的一条坏消息”。SARS-CoV-2中的“坏消息”是这种新型冠状病毒以非常长的核糖核酸(RNA)分子的形式携带它的神秘的基因组。在与COVID-19大流行的斗争中,世界似乎迷失了方向,无法发现这种冠状病毒(SARS-Cov-2)的组成。作为一种RNA病毒,SARS-Cov-2进入宿主细胞并复制它的基因组RNA(gRNA),并产生许多较小的称为“亚基因组RNA(subgenomic RNA)”的RNA。这些亚基因组RNA用于合成SARS-Cov-2所需的各种蛋白(刺突蛋白和包膜蛋白等)。因此,这些较小的RNA是干扰这种新型冠状病毒征服我们的免疫系统的良好靶标。尽管最近的研究报道了SARS-Cov-2的RNA基因组的序列,但是它们只能预测它的基因可能在哪里,从而让这个世界仍然迷失方向。
在一项新的研究中,来自韩国基础科学研究院、首尔大学和韩国疾病预防控制中心的研究人员成功地剖析了SARS-CoV-2 RNA基因组的结构。他们通过实验证实了这些预测的亚基因组RNA的存在,并且它们可经核糖体翻译为病毒蛋白。此外,他们分析了每个亚基因组RNA的序列信息,并揭示了这种病毒的基因在基因组RNA上的准确位置。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“The architecture of SARS-CoV-2 transcriptome”。论文通讯作者为韩国基础科学研究院RNA研究中心的Kim V. Narry教授和Chang Hyeshik教授。
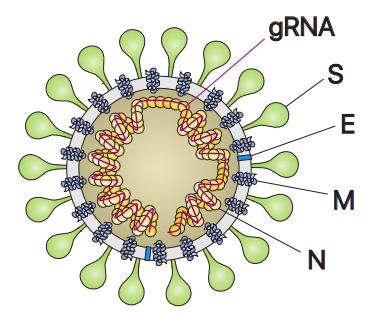
Kim说,“我们不仅详细描述了SARS-CoV-2的结构,而且还发现了许多新的病毒RNA和这些病毒RNA上存在的多种未知的化学修饰。我们的研究提供了SARS-CoV-2的高分辨率图谱。该图谱将有助于了解这种病毒如何复制以及它如何逃避人类防御系统的监视。”
先前已知10个亚基因组RNA组成了SARS-CoV-2的病毒颗粒结构。但是,这些研究人员证实实际上仅存在9个亚基因组RNA,这就使得剩下的一个亚基因组RNA作废了。他们还发现,由于RNA融合和缺失事件的发生,存在数十种未知的亚基因组RNA。
10.Nature:中国科学家揭示SARS-CoV-2主要蛋白酶的结构并发现其抑制剂
doi:10.1038/s41586-020-2223-y
一种新的冠状病毒(SARS-CoV-2)被鉴定为COVID-19病毒,它是引起2020年初COVID-19全球大流行的罪魁祸首。但是目前还没有针对性的治疗方法,且有效的治疗选择仍然非常有限。为了快速发现用于临床的先导化合物,来自上海科技大学的饶子和/杨海涛课题组与上海药物所的蒋华良课题组及其他单位合作,启动了一个联合结构辅助药物设计、虚拟药物筛选和高通量筛选的项目,以识别针对COVID-19病毒主蛋白酶(Mpro)的新药先导物,相关研究成果于4月9日发表在Nature上,题为"Structure of Mpro from COVID-19 virus and discovery of its inhibitors"。
Mpro是一种关键的SARS-CoV-2酶,在介导病毒复制和转录中起着关键作用,是该病毒具有吸引力的药物靶点。为此,研究人员通过计算机辅助药物设计鉴定了一种基于机理的抑制剂--N3,并随后确定了COVID-19病毒Mpro的晶体结构。
接下来,通过结合基于结构的虚拟和高通量筛选,研究人员分析了超过10,000种化合物,包括已批准的药物、临床试验中的候选药物,以及作为Mpro抑制剂的其他药理活性化合物。
研究人员发现了六个可以抑制Mpro的化合物额IC50值位于0.67μM到21.4 μM之间。Ebselen在细胞检测中也显示出了良好的抗病毒活性。
11.EMBO J:新冠病毒会伤害哪些细胞
doi:10.15252/embj.20105114
近日,来自柏林卫生研究所(BIH)、柏林大学医学中心(Charité - Universitätsmedizin Berlin)和海德堡大学附属医院胸科诊所的科学家们在德国肺部研究中心(DZL)的主持下,对来自非病毒感染患者的样本进行了检查,以确定哪些肺部和支气管细胞是新型冠状病毒(COVID19)感染的靶点。他们发现,COVID19病毒的受体在某些祖细胞中大量表达。这些细胞通常发育成呼吸道细胞。现在,科学家们在《EMBO journal》杂志上发表了他们的研究结果。
来自海德堡胸科诊所的Roland Eils教授和他的同事最初打算研究为什么肺癌有时会发生在从未吸烟的人身上。他们首先分析了12名肺癌患者的样本。他们还研究了健康患者呼吸道中的细胞,这些细胞是在进行支气管镜检查时以微创方式采集的。如今,迅速蔓延的冠状病毒疫情促使研究人员对这些现有的但至今尚未公布的数据进行了再次研究。"我相信,我们从这些非冠状病毒感染患者身上收集到的数据将为了解病毒感染提供重要的信息,"BIH数字健康中心创始主任Roland Eils说。
12.ChemBioChem:科学家或有望找到治疗COVID-19的新型药物
doi:10.1002/cbic.202000047
近日,随着全球COVID-19疫情的流行,来自德州农工大学的科学家们重点开始研究和寻找能够治疗COVID-19的药物,相关研究结果发表在ChemBioChem杂志上。
研究者Wenshe Ray Liu表示,在1月份我们发现,一种名为瑞德西韦(remdesivir)的抗病毒药物或能作用治疗COVID-19的潜力药物,该药物最初是用于应对2014年所爆发的埃博拉疫情的。作为一名从事药物化学研究的化学生物学家,研究者Liu的主要研究领域是癌症,但最近的疫情使他不得不开始重新关注SARS-CoV-2的研究了。
研究者指出,驱使我们研究的动机就是争分夺秒地寻找潜在的治疗性药物,来有效应对病毒的扩散,目前我们正在开发有效抑制SARS-CoV-2和其它冠状病毒在人体细胞中进行复制的新型药物,同时研究者还在深入研究如何去中和人类血液中病毒所产生的效应。目前研究人员在短期内取得了重大研究突破,如今他们已经将治疗COVID-19的候选药物推向了临床前试验,同时还会在疫情大流行小腿前开展临床试验。
13.Science子刊:第二种治疗SARS-CoV-2/COVID-19的神药有望面世!人细胞和小鼠研究表明EIDD-2801高效抑制多种冠状病毒
doi:10.1126/scitranslmed.abb5883
科学家们希望一种称为EIDD-2801的新药物可以改变医生治疗COVID-19的方式。这种药物显示出减少肺部损伤的前景,已在小鼠中完成了测试,不久将用于人体临床试验中。
学医学中心儿科教授Mark Denison实验室以及非营利组织埃默里大学药物创新企业(Drug Innovation Ventures at Emory, DRIVE)首席执行官和埃默里大学药物开发研究所主任George Painter合作开展研究。EIDD-2801正是在埃默里大学药物开发研究所那里发现的。

Baric及其研究团队的最新研究结果于2020年4月6日在线发表在Science Translational Medicine期刊上,论文标题为“An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice”。这篇论文包括来自体外培养的感染了SARS-CoV-2的人肺细胞和感染了相关冠状病毒SARS-CoV和MERS-CoV的小鼠的数据。
这项研究发现当用作预防剂时,EIDD-2801可以预防小鼠在受到感染后出现严重的肺部损伤。EIDD-2801是抗病毒化合物EIDD-1931的口服形式;它可以作为药丸服用,并能被适当吸收,然后进入肺部。
14.Lancet子刊:震惊!全球还有94%的新冠肺炎患者未被发现!
doi:10.1016/S1473-3099(20)30243-7
根据哥廷根大学最近的一份报告,各国和国际媒体广泛报道的新的冠状病毒疾病的确诊病例数量严重低于感染人数的真实数量。哥廷根大学的Christian Bommer博士和Sebastian Vollmer教授使用了The Lancet Infectious Diseases 杂志上的一项研究中COVID-19死亡率和病人直到死亡的时间的数据,来测试官方病例记录的质量。他们的数据显示,各国平均只有6%的冠状病毒感染者被确诊,而全世界感染者的真实数量可能已经达到了数千万。
测试不足和延迟可能解释了为什么一些欧洲国家,如意大利和西班牙,正在经历比德国更多的伤亡人数(相对于确诊病例),因为德国发现了约15.6%的感染者,而意大利只有3.5%,西班牙则是1.7%。美国和英国的检出率甚至更低,分别为1.6%和1.2%--这两个国家受到公共卫生专家的广泛批评,因为他们推迟了对大流行的反应。
与此形成鲜明对比的是,韩国似乎已经发现了近一半的SARS-CoV-2感染者。作者估计,在2020年3月31日,德国有46万感染者。根据同样的方法,他们计算美国有超过1000万,西班牙超过500万,意大利大约300万,英国大约200万感染。同一天,约翰·霍普金斯大学(Johns Hopkins University)报告说,在全球范围内只有不到90万的确诊病例,这意味着绝大多数感染没有被发现。
15.PNAS:COVID-19治疗重大进展!恢复期血浆一针见效!
doi:10.1073/pnas.2004168117
我国科学家发表的最新研究报告显示,对于10名感染新型冠状病毒的重症患者,从COVID-19中康复的患者血液中提取的单剂量抗体似乎可以挽救生命、缩短症状持续时间、提高氧含量并加速病毒清除。
这些初步的发现来自于近日发表在《PNAS》上的一项"试点研究"。这项研究在我国三家医院进行,科学家们从康复病人(也被称为恢复期血浆)体内中提取免疫抗体,并将其应用于与严重的COVID-19病例作斗争的病人。
但是它的发现提供了一种希望,一种有着悠久历史和简单前提的治疗方法可以成为治疗COVID-19呼吸困难患者的强有力的方法。在20世纪早期,医生将从小儿麻痹症、麻疹、腮腺炎和流感中康复的患者血液中携带的抗体转移到那些仍然受到感染的患者身上。医生观察到,有了以前感染者对病毒的免疫记忆,接受恢复期血浆治疗的患者似乎比未接受治疗的患者恢复得更快、更彻底。
16.medRxiv:研究开发更准确更灵敏的SARS-CoV-2测试方法
doi:10.1101/2020.02.29.20029439
密歇根州立大学的研究人员已经验证了一种检测冠状病毒的测试方法,这种方法比目前使用的方法更准确,可以帮助解决全国检测工具短缺的问题。不过,这种方法首先需要获得美国FDA的批准,然后才能广泛用于检测疑似患有由SARS-CoV-2引起的呼吸道疾病COVID-19的患者。
研究人员能够使用不同的化学试剂来进行标准测试,而不是使用那些短缺的试剂,并且液滴数字PCR仪能够在大约一天内产生结果。
"新的检测方法已经被证明比标准的冠状病毒检测敏感500倍,"人类医学学院转化神经科学系主任Jack Lipton说。"这很重要,因为它可以减少由于病毒载量低而将患者误诊为无病的假阴性检测结果的数量,特别是在那些尚未出现症状的患者中。"
17.Science发文,指出科学家们将冠状病毒SARS-CoV-2刺突蛋白的结构转化为音乐
doi:10.1126/science.abc0657
你很可能已经看过数十张SARS-CoV-2的图片,而如今这种冠状病毒导致了100万例感染病例和成千上万人的死亡。如今,科学家们找到了一种让你听到这种冠状病毒的方法:将它的广为人所知的刺突蛋白(S蛋白)的结构转化为音乐。
你听到的声音---钟鸣声、拨弦声、轻快的笛声---都代表了SARS-CoV-2刺突蛋白的不同方面。这种刺突蛋白从这种冠状病毒表面向外延伸出来,并帮助它结合到毫无戒心的宿主细胞上。像所有蛋白一样,这种刺突蛋白由氨基酸组合而成。通过使用一种称为可听化(sonification)的新技术,来自美国麻省理工学院的研究人员给每个氨基酸残基分配了音阶中的一个独特的音符,从而将这整个蛋白转化为初步的乐谱。
但是在现实生活中,这些氨基酸往往会卷曲成螺旋状或伸展成片状。这些研究人员通过更改音符的持续时间和音量来捕捉这些特征。由热引起的分子振动也会产生自己的声音。
但是,为什么要把病毒设置成音乐呢?这种新模式可以帮助科学家们找到这种刺突蛋白表面上抗体或药物可能能够结合的位点,只需搜索与这些位点相对应的特定音乐序列即可。这些研究人员说,这比用于研究蛋白的常规方法(比如分子建模)更快和更直观。他们补充说,通过将这种刺突蛋白的音乐序列与其他经过可听化处理的蛋白的大型数据库进行比较,可能有一天能找到一种结合这种刺突蛋白的蛋白,从而阻止这种冠状病毒感染细胞。
18.Radiology:新研究表明在某些情况下,SARS-CoV-2/COVID-19可能会损害大脑
doi:10.1148/radiol.2020201187
一名50多岁的女性在航空业工作。她由于前三天出现咳嗽、发烧和精神错乱,前往位于美国底特律的亨利福特医疗集团(Henry Ford Health System)进行治疗。
鼻拭子测试显示她感染了新型冠状病毒SARS-CoV-2。当医生试图找出“她的精神状态改变”的原因时,大脑扫描显示出一种脑病---脑部某些区域出现肿胀---以及小部分脑细胞死亡。
亨利福特医疗集团放射科医生Brent Griffith博士领导的一个研究小组认为这种疾病在成年人中相对罕见,而且可能致命。
这位女性的医生在近期发表在Radiology期刊上的一篇论文中写道,“虽然[COVID-19]患者通常表现为发烧、呼吸急促和咳嗽,但是神经系统的临床表现有所报道,报道的程度要小得多。”他们的诊断结果是:“与COVID-19相关的急性坏死性出血性脑病(acute necrotizing hemorrhagic encephalopathy),这是一种罕见的与其他病毒感染有关的脑病。”
19.震惊!JAMA研究发现携带冠状病毒的飞沫可以飞行8米远!
doi:10.1001/jama.2020.4756
麻省理工学院副教授Lydia Bourouiba多年来一直在疾病传播流体动力学实验室研究呼出气体的动力学(比如咳嗽和打喷嚏),她发现呼出气体会产生高达27英尺(8.2米)的气体云。
尽管美国疾病控制与预防中心(CDC)和世界卫生组织(WHO)呼吁采取的措施分别需要六英尺(0.9米)和三英尺(1.8米)的空间,但她的研究可能会对全球的COVID-19大流行产生影响。
Bourouiba的研究呼吁采取更好的措施来保护医护人员,并尽可能与咳嗽或打喷嚏的感染者保持更大的距离。她说,目前的指导方针是基于"大液滴"作为病毒传播的方法以及这些大液滴只能传播一定距离的想法。
在美国医学会杂志上周发表的一篇文章中,Bourouiba说,呼气的最高速度可以达到每秒33到100英尺(36公里/小时和110公里/小时),"目前使用的外科手术口罩和N95口罩标准没有测试这些潜在的呼吸排放特征。"
20.PLoS ONE期刊发表两篇关于COVID-19疫情的论文
doi:10.1371/journal.pone.0230405; doi:10.1371/journal.pone.0230548
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。近期开放获取期刊PLoS ONE发表了两项有关COVID-19疫情爆发的研究。
第一项研究于2020年3月31日发表,由意大利那不勒斯费德里科二世大学的Constantinos Siettos及其同事们开展。这些作者使用了一个利用2020年1月11日至2月10日的报道数据进行校准的易受感染-感染-恢复-死亡(Susceptible-Infected-Recovered-Dead, SIRD)模型,并预测了截至2月29日在中国湖北疫情中心的疫情演变。通过使用这些参数,他们预测截至2月29日,在湖北至少将有45000人被感染,2700人死亡---实际情形是在此期间已有大约67000人被感染,死亡人数约为2800人。

这些作者还使用SIRD模型来估计COVID-19的R0值,这是对病毒传染性的一种估计值,它反映了一个感染者平均可能感染多少人。在各种情况下,他们基于获得的数据估算R0约为2.5。假设这些数据中的轻度COVID-19病例存在较高的低估,他们估计这种病毒在总人口中的死亡率约为0.15%。此外,基于感染人数在总人口中按20倍的比例进行扩展的假设,这项研究预测到2月底湖北的疫情将有所下降。事实上,在过去几天里,新感染病例的数量已经显著下降。
第二项研究于2020年3月19日发表,由中国湖北省武汉市中心医院的Mingli Yuan博士及其同事们开展。这些研究人员研究了27例感染COVID-19并入住武汉市中心医院的患者。
在这组患者中,这些作者将通过对患者肺部进行CT扫描确定的临床特征与最终结果相关联。他们根据观察到的临床特征(比如毛玻璃片混浊、两侧异常和肺部病变广泛分布)对患者进行评分,从而为每名患者提供了一个总体严重程度评分。
在这27例患者中,大多数是老年人(中位年龄为60岁),其中17例(63%)康复并出院,10例(37%)死于这种病毒感染。具有基础健康疾病(包括高血压、糖尿病和心脏病)的患者比没有这些合并症的患者更容易死于这种病毒感染,年龄较大的患者也更容易死亡,而且在这些方面没有性别差异。CT扫描评分更高(更严重)的患者更有可能死于COVID-19:康复并出院的患者的评分为12,而死亡患者的平均评分为30。(生物谷 Bioon.com)
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对近期2019-nCoV/COVID-19研究取得的进展进行一番梳理,以飨读者。
1.bioRxiv:解析包被SARS-CoV-2刺突蛋白的聚糖分子的结构 有望帮助开发新型候选疫苗
doi:10.1101/2020.03.26.010322
日前,一项刊登在预印版平台bioRxiv上的研究报告中,来自南安普敦大学等机构的科学家们通过研究揭示了引发COVID-19的冠状病毒SARS-CoV-2的基本特征,文章中,研究人员首次开发出了该病毒刺突蛋白的模型,同时揭示了病毒如何进行自我伪装在不被宿主发现的情况下进入宿主细胞,研究者希望以这种病毒蛋白为靶点来开发新型抗体和疫苗。

图片来源:University of Southampton。
SARS-CoV-2表面有大量的刺突蛋白,其能吸附并进入人类宿主机体细胞,这些刺突表面被聚糖分子包括,其能伪装病毒蛋白并帮其躲避宿主免疫系统的监视,最终成功进入宿主细胞。这项研究中,研究人员利用先进的技术对覆盖在病毒刺突蛋白模拟物表面的聚糖分子的结构进行了相关研究;随后他们绘制出了这些聚糖分子的图谱,基于该图谱,研究人员就能阐明病毒蛋白表面如何与抗体进行结合,这对于疫苗设计至关重要。
研究者Crispin教授说道,通过给病毒刺突蛋白包裹聚糖分子,病毒就会像披着羊皮的狼一样,本文研究的一个重要发现是,不管病毒刺突蛋白上有多少糖分子,这种冠状病毒或许并不像其它病毒那样拥有高度的防护能力。诸如HIV等病毒会在宿主体内不断游荡,其必须不断躲避宿主的免疫系统监视,且拥有一层非常密集的聚糖来作为抵御宿主免疫系统的盾牌。但在SARS-CoV-2背景下,附着在病毒表面较低庇护能力的糖分子或许就反映出了该病毒是一种“打了就跑”的病毒,其会从一个人传播到另一个人身上,然而较低的聚糖浓度也意味着免疫系统使用抗体中和病毒的障碍更少一些,这对于后期疫苗的开发而言或许是一件非常重要的事情。
2.Cell子刊:开发出一种可用于对抗SARS-CoV-2/COVID-19的新系统
doi:10.1016/j.chom.2020.04.004
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国德克萨斯大学加尔维斯顿医学分部的研究人员在致力于抗击SARS-CoV-2的过程中开发出一种新的系统,它将使得科学家们更快地开发疫苗和评估开发中的疫苗、诊断感染者并探究这种冠状病毒如何进化。相关研究结果以论文手稿的形式在线发表在Cell Host & Microbe期刊上,论文标题为“An infectious cDNA clone of SARS-CoV-2”。
在德克萨斯大学加尔维斯顿医学分部人类遗传学教授Pei-Yong Shi博士的领导下,这些研究人员通过对一种反向遗传操作系统进行改造而开发出这种针对SARS-CoV-2的新系统。
反向遗传操作系统是研究和对抗病毒最有用的工具之一。这种系统允许科学家们在实验室中制造病毒,并在培养皿中操纵它。通过对这种系统进行改造,这些研究人员设计出了SARS-CoV-2病毒的一个改造版本,从而使得它被标记上霓虹绿(neon green)。当这种被标记的病毒感染细胞时,被感染的细胞会变成绿色。
3.Antivir Res:冠状病毒膜融合机制为抗病毒药物的开发提供了一种潜在的靶标
doi:10.1016/j.antiviral.2020.104792
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国康奈尔大学的研究人鉴定出COVID-19抗病毒治疗的一个潜在的靶标。相关研究结果于2020年4月6日在线发表在Antiviral Research期刊上,论文标题为“Coronavirus membrane fusion mechanism offers as a potential target for antiviral development”
这些研究人员起初着手分析了严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV)的结构和特征,重点研究了刺突蛋白--特别是它的融合肽---如何让这两种冠状病毒通过转移它们的基因组来感染宿主细胞。随着当前的COVID-19疫情的不断加剧,他们将SARS-CoV和SARS-CoV-2的融合肽序列进行了比较,发现它们的序列匹配度高达93%。
康奈尔大学的Susan Daniel研究团队专门研究细胞膜的生物物理学特性;康奈尔大学的Gary Whittaker研究团队研究流感病毒和冠状病毒进入宿主细胞。Daniel团队和Whittaker团队组成的一个联合小组正在深入研究这种膜融合---冠状病毒传播机制的关键部分---的复杂过程。
4.mBio:开发针对SARS-CoV-2的疫苗有戏!低剂量PIV5疫苗鼻腔接种让小鼠免受致命剂量MERS-CoV感染
doi:10.1128/mBio.00554-20
在一项新的研究中,来自美国爱荷华大学和佐治亚大学的研究人员开发出了一种疫苗,可以完全保护小鼠免受致命剂量的MERS-CoV的伤害。这种疫苗利用一种无害的病毒将一种MERS-CoV蛋白递送到细胞内以产生免疫反应,这可能为开发针对包括COVID-19在内的其他冠状病毒病的疫苗提供了希望。相关研究结果于2020年4月7日在线发表在mBio期刊上,论文标题为“Single-Dose, Intranasal Immunization with Recombinant Parainfluenza Virus 5 Expressing Middle East Respiratory Syndrome Coronavirus (MERS-CoV) Spike Protein Protects Mice from Fatal MERS-CoV Infection”。论文通讯作者为爱荷华大学卡佛医学院的Paul McCray博士和佐治亚大学兽医学院的Biao He博士。

图片来自mBio, 2020, doi:10.1128/mBio.00554-20。
这些研究人员在一种经过基因改造后对MERS-CoV敏感的小鼠中测试了一种候选疫苗。这种疫苗是一种无害的携带MERS-CoV用来感染宿主细胞的刺突蛋白的副流感病毒(PIV5)。所有接种过这种疫苗的小鼠都在致命剂量的MERS-CoV攻击下存活了下来。
McCray说,“我们的新研究表明PIV5可能是一种针对新出现的冠状病毒病(包括COVID-19)的有用疫苗平台。通过使用同样的策略,基于表达SARS-CoV-2刺突蛋白的PIV5的候选疫苗已经产生了。我们正计划在动物中进行更多的研究,以测试基于PIV5的疫苗在预防SARS-CoV-2引起的疾病方面的能力。”
5.Nat Med:科学家们呼吁采取全球应对措施,保护COVID-19疫情大爆发期间最脆弱的人群
doi:10.1038/s41591-020-0851-2
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。2020年4月8日,一篇发表在Nature Medicine期刊上的标题为“COVID-19 in humanitarian settings and lessons learned from past epidemics”的评论性论文呼吁采取全球应对措施,保护COVID-19疫情大爆发期间最脆弱的人群。
这些作者指出,包括难民和移民在内的流离失所者往往首先受到污名化,并被不公正地归咎于导致疾病传播,但是在COVID-19疫情大爆发期间,他们也是最易受SARS-CoV-2病毒本身以及采取的控制它的措施影响的人群之一。
这篇论文借鉴了哥伦比亚大学梅尔曼公共卫生学院强迫移民与健康项目(Program on Forced Migration and Health)的工作人员在接受部署后目前实地从事人道主义响应和卫生系统加强工作过程中获得的集体实地经验。
6.PNAS:揭开COVID-19早期进化路径,或揭秘新冠病毒起源之谜!
doi:10.1073/pnas.2004999117
来自剑桥、英国和德国的研究人员利用基因网络技术,重建了COVID-19在人类身上的早期"进化路径"。通过分析第一批160个完整的病毒基因组,他们已经绘制出了一些新的冠状病毒通过其突变的原始传播,而这些突变产生了不同的病毒谱系。
研究人员使用的系统发育网络方法--允许在一个简单的图表中同时可视化数百棵进化树--这种方法于1979年在新西兰率先使用,然后在20世纪90年代由德国数学家开发。
剑桥大学的首席作者、遗传学家Peter Forster博士说:"有太多的快速突变,因此很难精确地追踪到一个COVID-19系谱树。我们使用数学网络算法来同时可视化所有可能的谱树。这些技术主要是通过DNA来绘制史前人类的运动轨迹。我们认为这是第一次使用它们来追踪像COVID-19这样的冠状病毒的感染途径。"
7.JVI:新研究表明小分子化合物EIDD-1931可抑制包括鼠肝炎病毒和MERS-CoV在内的一系列冠状病毒
doi:10.1128/JVI.01348-19
小分子胞苷类似物β-d-N4-羟胞苷(β-d-N4-Hydroxycytidine, NHC,也称为EIDD-1931,由美国埃默里大学药物开发研究所开发)最近已被证明可抑制多种病毒,包括基孔肯雅病毒、委内瑞拉马脑炎病毒(VEEV)、呼吸道合胞病毒(RSV)、丙型肝炎病毒(HCV)、诺如病毒、甲型流感病毒(IAV)、乙型流感病毒和埃博拉病毒。先前的报道显示了在治疗后病毒基因组中转换突变(transition mutation)的增加。人们还报道了EIDD-1931对人α冠状病毒HCoV-NL63和β冠状病毒SARS-CoV的抗病毒活性。迄今为止,科学家们尚未报道EIDD-1931抑制任何冠状病毒的作用机制,也未报道过冠状病毒对EIDD-1931的耐药性。
在一项新的研究中,来自美国范德堡大学医学院、埃默里大学和北卡罗来纳大学教堂山分校的研究人员研究了EIDD-1931对两种不同的β冠状病毒---鼠肝炎病毒(MHV)和MERS-CoV---的抑制作用以及这两种冠状病毒对EIDD-1931的耐药性。相关研究结果近期发表在Journal of Virology期刊上,论文标题为“Small-Molecule Antiviral β-d-N4-Hydroxycytidine Inhibits a Proofreading-Intact Coronavirus with a High Genetic Barrier to Resistance”。
他们发现EIDD-1931可强效抑制野生型鼠肝炎病毒(EC50=0.17 μM)和MERS-CoV(EC50 = 0.56 μM),而且它的细胞毒性很小。他们还证实鼠肝炎病毒的3'-5'核糖核酸外切酶的校对活性对EIDD-1931敏感性的影响有限,但可以测量到。
EIDD-1931对野生型鼠肝炎病毒和缺乏3'-5'核糖核酸外切酶活性的鼠肝炎病毒的抑制是相类似的,这表明它能够逃避或克服3'-5'核糖核酸外切酶活性的能力。仅在感染早期添加时,EIDD-1931才能够抑制鼠肝炎病毒、降低病毒的特异性感染能力和增加在单次感染后存在的G:A和C:U转换突变的数量和比例。
低水平的EIDD-1931耐药性难以实现,这与鼠肝炎病毒和MERS-CoV整个基因组中出现的多个转换突变有关。他们观察到EIDD-1931的抑制谱与以转换突变的积累为特征的诱变作用机制相一致,这表明耐药性的 遗传屏障很高。
8.NEJM:临床试验初步表明瑞德西韦可导致68%的重度COVID-19患者出现临床改善
doi:10.1056/NEJMoa2007016
瑞德西韦(remdesivir, 也称为GS-5734)是核苷酸类似物的前体药物(prodrug),它在细胞内代谢为抑制病毒RNA聚合酶的三磷酸腺苷类似物。瑞德西韦对包括线状病毒(比如埃博拉病毒)和冠状病毒(比如SARS-CoV和中东呼吸综合征冠状病毒[MERS-CoV])在内的几种病毒家族的成员具有广谱活性,并且已在非临床模型中对这些冠状病毒显示出预防性和治疗性的功效。体外测试还显示,瑞德西韦具有抗SARS-CoV-2的活性。根据包括健康志愿者和因急性埃博拉病毒感染而接受治疗的患者在内的大约500人的经验报告,瑞德西韦似乎具有良好的临床安全性。
在一项新的临床研究中,来自美国、日本、意大利、法国、加拿大、西班牙、荷兰和奥地利的研究人员描述了在同情使用的基础上接受瑞德西韦治疗重症COVID-19住院患者的临床结果。相关研究结果于2020年4月10日发表在NEJM期刊上,论文标题为“Compassionate Use of Remdesivir for Patients with Severe Covid-19”。
迄今为止,尚无疗法证明对COVID-19患者有效。这项初步的临床研究描述了一小群患有重度COVID-19并接受瑞德西韦治疗的患者的临床结果。尽管来自多个正在进行的随机对照临床试验的数据很快将提供有关瑞德西韦治疗COVID-19的安全性和有效性的更多信息,但是在这种同情使用方案中观察到的结果是目前可获得的最佳数据。具体而言,在68%的患者中观察到了氧气支持状态的改善,中位随访18天的总死亡率为13%。
对这项临床研究的结果的解释受限于患者队列的规模较小,随访时间相对较短,由于这种同情使用方案的性质而导致的潜在数据丢失,缺乏有关最初治疗的8例患者的信息以及缺乏随机对照组。尽管随机对照组的缺乏无法得出明确的结论,但是与文献中的同期队列(一般护理据预计与这项临床研究中的患者队列相一致)比较表明瑞德西韦在重度COVID-19患者中可能具有临床益处。但是,其他因素也可能导致结果差异,包括支持性治疗的类型(比如,伴随用药或通气方式的变化)以及机构治疗方案和住院门槛的差异。此外,使用有创通气作为疾病严重程度的一种指标可能会受到在特定位置呼吸机使用状况的影响。不过基于这些非对照数据的发现将会给正在进行的利用瑞德西韦治疗COVID-19的随机、安慰剂对照临床试验提供有用的信息。
9.Cell:新研究绘制出SARS-CoV-2的高分辨率基因图谱,并指出这种病毒的基因组仅由9个亚基因组RNA组成
doi:10.1016/j.cell.2020.04.011
在1977年,Jean Medawar和Peter Medawar写道,病毒“只是包裹在蛋白中的一条坏消息”。SARS-CoV-2中的“坏消息”是这种新型冠状病毒以非常长的核糖核酸(RNA)分子的形式携带它的神秘的基因组。在与COVID-19大流行的斗争中,世界似乎迷失了方向,无法发现这种冠状病毒(SARS-Cov-2)的组成。作为一种RNA病毒,SARS-Cov-2进入宿主细胞并复制它的基因组RNA(gRNA),并产生许多较小的称为“亚基因组RNA(subgenomic RNA)”的RNA。这些亚基因组RNA用于合成SARS-Cov-2所需的各种蛋白(刺突蛋白和包膜蛋白等)。因此,这些较小的RNA是干扰这种新型冠状病毒征服我们的免疫系统的良好靶标。尽管最近的研究报道了SARS-Cov-2的RNA基因组的序列,但是它们只能预测它的基因可能在哪里,从而让这个世界仍然迷失方向。
在一项新的研究中,来自韩国基础科学研究院、首尔大学和韩国疾病预防控制中心的研究人员成功地剖析了SARS-CoV-2 RNA基因组的结构。他们通过实验证实了这些预测的亚基因组RNA的存在,并且它们可经核糖体翻译为病毒蛋白。此外,他们分析了每个亚基因组RNA的序列信息,并揭示了这种病毒的基因在基因组RNA上的准确位置。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“The architecture of SARS-CoV-2 transcriptome”。论文通讯作者为韩国基础科学研究院RNA研究中心的Kim V. Narry教授和Chang Hyeshik教授。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.011。
Kim说,“我们不仅详细描述了SARS-CoV-2的结构,而且还发现了许多新的病毒RNA和这些病毒RNA上存在的多种未知的化学修饰。我们的研究提供了SARS-CoV-2的高分辨率图谱。该图谱将有助于了解这种病毒如何复制以及它如何逃避人类防御系统的监视。”
先前已知10个亚基因组RNA组成了SARS-CoV-2的病毒颗粒结构。但是,这些研究人员证实实际上仅存在9个亚基因组RNA,这就使得剩下的一个亚基因组RNA作废了。他们还发现,由于RNA融合和缺失事件的发生,存在数十种未知的亚基因组RNA。
10.Nature:中国科学家揭示SARS-CoV-2主要蛋白酶的结构并发现其抑制剂
doi:10.1038/s41586-020-2223-y
一种新的冠状病毒(SARS-CoV-2)被鉴定为COVID-19病毒,它是引起2020年初COVID-19全球大流行的罪魁祸首。但是目前还没有针对性的治疗方法,且有效的治疗选择仍然非常有限。为了快速发现用于临床的先导化合物,来自上海科技大学的饶子和/杨海涛课题组与上海药物所的蒋华良课题组及其他单位合作,启动了一个联合结构辅助药物设计、虚拟药物筛选和高通量筛选的项目,以识别针对COVID-19病毒主蛋白酶(Mpro)的新药先导物,相关研究成果于4月9日发表在Nature上,题为"Structure of Mpro from COVID-19 virus and discovery of its inhibitors"。
Mpro是一种关键的SARS-CoV-2酶,在介导病毒复制和转录中起着关键作用,是该病毒具有吸引力的药物靶点。为此,研究人员通过计算机辅助药物设计鉴定了一种基于机理的抑制剂--N3,并随后确定了COVID-19病毒Mpro的晶体结构。
接下来,通过结合基于结构的虚拟和高通量筛选,研究人员分析了超过10,000种化合物,包括已批准的药物、临床试验中的候选药物,以及作为Mpro抑制剂的其他药理活性化合物。
研究人员发现了六个可以抑制Mpro的化合物额IC50值位于0.67μM到21.4 μM之间。Ebselen在细胞检测中也显示出了良好的抗病毒活性。
11.EMBO J:新冠病毒会伤害哪些细胞
doi:10.15252/embj.20105114
近日,来自柏林卫生研究所(BIH)、柏林大学医学中心(Charité - Universitätsmedizin Berlin)和海德堡大学附属医院胸科诊所的科学家们在德国肺部研究中心(DZL)的主持下,对来自非病毒感染患者的样本进行了检查,以确定哪些肺部和支气管细胞是新型冠状病毒(COVID19)感染的靶点。他们发现,COVID19病毒的受体在某些祖细胞中大量表达。这些细胞通常发育成呼吸道细胞。现在,科学家们在《EMBO journal》杂志上发表了他们的研究结果。
来自海德堡胸科诊所的Roland Eils教授和他的同事最初打算研究为什么肺癌有时会发生在从未吸烟的人身上。他们首先分析了12名肺癌患者的样本。他们还研究了健康患者呼吸道中的细胞,这些细胞是在进行支气管镜检查时以微创方式采集的。如今,迅速蔓延的冠状病毒疫情促使研究人员对这些现有的但至今尚未公布的数据进行了再次研究。"我相信,我们从这些非冠状病毒感染患者身上收集到的数据将为了解病毒感染提供重要的信息,"BIH数字健康中心创始主任Roland Eils说。
12.ChemBioChem:科学家或有望找到治疗COVID-19的新型药物
doi:10.1002/cbic.202000047
近日,随着全球COVID-19疫情的流行,来自德州农工大学的科学家们重点开始研究和寻找能够治疗COVID-19的药物,相关研究结果发表在ChemBioChem杂志上。
研究者Wenshe Ray Liu表示,在1月份我们发现,一种名为瑞德西韦(remdesivir)的抗病毒药物或能作用治疗COVID-19的潜力药物,该药物最初是用于应对2014年所爆发的埃博拉疫情的。作为一名从事药物化学研究的化学生物学家,研究者Liu的主要研究领域是癌症,但最近的疫情使他不得不开始重新关注SARS-CoV-2的研究了。
研究者指出,驱使我们研究的动机就是争分夺秒地寻找潜在的治疗性药物,来有效应对病毒的扩散,目前我们正在开发有效抑制SARS-CoV-2和其它冠状病毒在人体细胞中进行复制的新型药物,同时研究者还在深入研究如何去中和人类血液中病毒所产生的效应。目前研究人员在短期内取得了重大研究突破,如今他们已经将治疗COVID-19的候选药物推向了临床前试验,同时还会在疫情大流行小腿前开展临床试验。
13.Science子刊:第二种治疗SARS-CoV-2/COVID-19的神药有望面世!人细胞和小鼠研究表明EIDD-2801高效抑制多种冠状病毒
doi:10.1126/scitranslmed.abb5883
科学家们希望一种称为EIDD-2801的新药物可以改变医生治疗COVID-19的方式。这种药物显示出减少肺部损伤的前景,已在小鼠中完成了测试,不久将用于人体临床试验中。
学医学中心儿科教授Mark Denison实验室以及非营利组织埃默里大学药物创新企业(Drug Innovation Ventures at Emory, DRIVE)首席执行官和埃默里大学药物开发研究所主任George Painter合作开展研究。EIDD-2801正是在埃默里大学药物开发研究所那里发现的。

EIDD-2801和EIDD-1931(也缩写为NHC)的化学结构式,图片来自Science Translational Medicine, 2019, doi:10.1126/scitranslmed.aax5866。
Baric及其研究团队的最新研究结果于2020年4月6日在线发表在Science Translational Medicine期刊上,论文标题为“An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice”。这篇论文包括来自体外培养的感染了SARS-CoV-2的人肺细胞和感染了相关冠状病毒SARS-CoV和MERS-CoV的小鼠的数据。
这项研究发现当用作预防剂时,EIDD-2801可以预防小鼠在受到感染后出现严重的肺部损伤。EIDD-2801是抗病毒化合物EIDD-1931的口服形式;它可以作为药丸服用,并能被适当吸收,然后进入肺部。
14.Lancet子刊:震惊!全球还有94%的新冠肺炎患者未被发现!
doi:10.1016/S1473-3099(20)30243-7
根据哥廷根大学最近的一份报告,各国和国际媒体广泛报道的新的冠状病毒疾病的确诊病例数量严重低于感染人数的真实数量。哥廷根大学的Christian Bommer博士和Sebastian Vollmer教授使用了The Lancet Infectious Diseases 杂志上的一项研究中COVID-19死亡率和病人直到死亡的时间的数据,来测试官方病例记录的质量。他们的数据显示,各国平均只有6%的冠状病毒感染者被确诊,而全世界感染者的真实数量可能已经达到了数千万。
测试不足和延迟可能解释了为什么一些欧洲国家,如意大利和西班牙,正在经历比德国更多的伤亡人数(相对于确诊病例),因为德国发现了约15.6%的感染者,而意大利只有3.5%,西班牙则是1.7%。美国和英国的检出率甚至更低,分别为1.6%和1.2%--这两个国家受到公共卫生专家的广泛批评,因为他们推迟了对大流行的反应。
与此形成鲜明对比的是,韩国似乎已经发现了近一半的SARS-CoV-2感染者。作者估计,在2020年3月31日,德国有46万感染者。根据同样的方法,他们计算美国有超过1000万,西班牙超过500万,意大利大约300万,英国大约200万感染。同一天,约翰·霍普金斯大学(Johns Hopkins University)报告说,在全球范围内只有不到90万的确诊病例,这意味着绝大多数感染没有被发现。
15.PNAS:COVID-19治疗重大进展!恢复期血浆一针见效!
doi:10.1073/pnas.2004168117
我国科学家发表的最新研究报告显示,对于10名感染新型冠状病毒的重症患者,从COVID-19中康复的患者血液中提取的单剂量抗体似乎可以挽救生命、缩短症状持续时间、提高氧含量并加速病毒清除。
这些初步的发现来自于近日发表在《PNAS》上的一项"试点研究"。这项研究在我国三家医院进行,科学家们从康复病人(也被称为恢复期血浆)体内中提取免疫抗体,并将其应用于与严重的COVID-19病例作斗争的病人。
但是它的发现提供了一种希望,一种有着悠久历史和简单前提的治疗方法可以成为治疗COVID-19呼吸困难患者的强有力的方法。在20世纪早期,医生将从小儿麻痹症、麻疹、腮腺炎和流感中康复的患者血液中携带的抗体转移到那些仍然受到感染的患者身上。医生观察到,有了以前感染者对病毒的免疫记忆,接受恢复期血浆治疗的患者似乎比未接受治疗的患者恢复得更快、更彻底。
16.medRxiv:研究开发更准确更灵敏的SARS-CoV-2测试方法
doi:10.1101/2020.02.29.20029439
密歇根州立大学的研究人员已经验证了一种检测冠状病毒的测试方法,这种方法比目前使用的方法更准确,可以帮助解决全国检测工具短缺的问题。不过,这种方法首先需要获得美国FDA的批准,然后才能广泛用于检测疑似患有由SARS-CoV-2引起的呼吸道疾病COVID-19的患者。
研究人员能够使用不同的化学试剂来进行标准测试,而不是使用那些短缺的试剂,并且液滴数字PCR仪能够在大约一天内产生结果。
"新的检测方法已经被证明比标准的冠状病毒检测敏感500倍,"人类医学学院转化神经科学系主任Jack Lipton说。"这很重要,因为它可以减少由于病毒载量低而将患者误诊为无病的假阴性检测结果的数量,特别是在那些尚未出现症状的患者中。"
17.Science发文,指出科学家们将冠状病毒SARS-CoV-2刺突蛋白的结构转化为音乐
doi:10.1126/science.abc0657
你很可能已经看过数十张SARS-CoV-2的图片,而如今这种冠状病毒导致了100万例感染病例和成千上万人的死亡。如今,科学家们找到了一种让你听到这种冠状病毒的方法:将它的广为人所知的刺突蛋白(S蛋白)的结构转化为音乐。
你听到的声音---钟鸣声、拨弦声、轻快的笛声---都代表了SARS-CoV-2刺突蛋白的不同方面。这种刺突蛋白从这种冠状病毒表面向外延伸出来,并帮助它结合到毫无戒心的宿主细胞上。像所有蛋白一样,这种刺突蛋白由氨基酸组合而成。通过使用一种称为可听化(sonification)的新技术,来自美国麻省理工学院的研究人员给每个氨基酸残基分配了音阶中的一个独特的音符,从而将这整个蛋白转化为初步的乐谱。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.02.058。
但是在现实生活中,这些氨基酸往往会卷曲成螺旋状或伸展成片状。这些研究人员通过更改音符的持续时间和音量来捕捉这些特征。由热引起的分子振动也会产生自己的声音。
但是,为什么要把病毒设置成音乐呢?这种新模式可以帮助科学家们找到这种刺突蛋白表面上抗体或药物可能能够结合的位点,只需搜索与这些位点相对应的特定音乐序列即可。这些研究人员说,这比用于研究蛋白的常规方法(比如分子建模)更快和更直观。他们补充说,通过将这种刺突蛋白的音乐序列与其他经过可听化处理的蛋白的大型数据库进行比较,可能有一天能找到一种结合这种刺突蛋白的蛋白,从而阻止这种冠状病毒感染细胞。
18.Radiology:新研究表明在某些情况下,SARS-CoV-2/COVID-19可能会损害大脑
doi:10.1148/radiol.2020201187
一名50多岁的女性在航空业工作。她由于前三天出现咳嗽、发烧和精神错乱,前往位于美国底特律的亨利福特医疗集团(Henry Ford Health System)进行治疗。
鼻拭子测试显示她感染了新型冠状病毒SARS-CoV-2。当医生试图找出“她的精神状态改变”的原因时,大脑扫描显示出一种脑病---脑部某些区域出现肿胀---以及小部分脑细胞死亡。
亨利福特医疗集团放射科医生Brent Griffith博士领导的一个研究小组认为这种疾病在成年人中相对罕见,而且可能致命。
这位女性的医生在近期发表在Radiology期刊上的一篇论文中写道,“虽然[COVID-19]患者通常表现为发烧、呼吸急促和咳嗽,但是神经系统的临床表现有所报道,报道的程度要小得多。”他们的诊断结果是:“与COVID-19相关的急性坏死性出血性脑病(acute necrotizing hemorrhagic encephalopathy),这是一种罕见的与其他病毒感染有关的脑病。”
19.震惊!JAMA研究发现携带冠状病毒的飞沫可以飞行8米远!
doi:10.1001/jama.2020.4756
麻省理工学院副教授Lydia Bourouiba多年来一直在疾病传播流体动力学实验室研究呼出气体的动力学(比如咳嗽和打喷嚏),她发现呼出气体会产生高达27英尺(8.2米)的气体云。
尽管美国疾病控制与预防中心(CDC)和世界卫生组织(WHO)呼吁采取的措施分别需要六英尺(0.9米)和三英尺(1.8米)的空间,但她的研究可能会对全球的COVID-19大流行产生影响。
Bourouiba的研究呼吁采取更好的措施来保护医护人员,并尽可能与咳嗽或打喷嚏的感染者保持更大的距离。她说,目前的指导方针是基于"大液滴"作为病毒传播的方法以及这些大液滴只能传播一定距离的想法。
在美国医学会杂志上周发表的一篇文章中,Bourouiba说,呼气的最高速度可以达到每秒33到100英尺(36公里/小时和110公里/小时),"目前使用的外科手术口罩和N95口罩标准没有测试这些潜在的呼吸排放特征。"
20.PLoS ONE期刊发表两篇关于COVID-19疫情的论文
doi:10.1371/journal.pone.0230405; doi:10.1371/journal.pone.0230548
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。近期开放获取期刊PLoS ONE发表了两项有关COVID-19疫情爆发的研究。
第一项研究于2020年3月31日发表,由意大利那不勒斯费德里科二世大学的Constantinos Siettos及其同事们开展。这些作者使用了一个利用2020年1月11日至2月10日的报道数据进行校准的易受感染-感染-恢复-死亡(Susceptible-Infected-Recovered-Dead, SIRD)模型,并预测了截至2月29日在中国湖北疫情中心的疫情演变。通过使用这些参数,他们预测截至2月29日,在湖北至少将有45000人被感染,2700人死亡---实际情形是在此期间已有大约67000人被感染,死亡人数约为2800人。

图片来自PLoS ONE, 2020, doi:10.1371/journal.pone.0230405。
这些作者还使用SIRD模型来估计COVID-19的R0值,这是对病毒传染性的一种估计值,它反映了一个感染者平均可能感染多少人。在各种情况下,他们基于获得的数据估算R0约为2.5。假设这些数据中的轻度COVID-19病例存在较高的低估,他们估计这种病毒在总人口中的死亡率约为0.15%。此外,基于感染人数在总人口中按20倍的比例进行扩展的假设,这项研究预测到2月底湖北的疫情将有所下降。事实上,在过去几天里,新感染病例的数量已经显著下降。
第二项研究于2020年3月19日发表,由中国湖北省武汉市中心医院的Mingli Yuan博士及其同事们开展。这些研究人员研究了27例感染COVID-19并入住武汉市中心医院的患者。
在这组患者中,这些作者将通过对患者肺部进行CT扫描确定的临床特征与最终结果相关联。他们根据观察到的临床特征(比如毛玻璃片混浊、两侧异常和肺部病变广泛分布)对患者进行评分,从而为每名患者提供了一个总体严重程度评分。
在这27例患者中,大多数是老年人(中位年龄为60岁),其中17例(63%)康复并出院,10例(37%)死于这种病毒感染。具有基础健康疾病(包括高血压、糖尿病和心脏病)的患者比没有这些合并症的患者更容易死于这种病毒感染,年龄较大的患者也更容易死亡,而且在这些方面没有性别差异。CT扫描评分更高(更严重)的患者更有可能死于COVID-19:康复并出院的患者的评分为12,而死亡患者的平均评分为30。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


