Nat Biotechnol:利用改进的CRISPR-Cas9基因编辑系统将较长的DNA序列高效引入细胞基因组中的精确位点
来源:生物谷原创 2022-08-30 10:31
CRISPR-Cas9基因编辑系统的一种新变体使得它更容易为治疗应用而对大量细胞进行基因改造。
CRISPR-Cas9基因编辑系统的一种新变体使得它更容易为治疗应用而对大量细胞进行基因改造。美国格拉斯通研究所和加州大学旧金山分校开发的这种方法让科学家们能够以非常高的效率将特别长的DNA序列引入细胞基因组的精确位置,而不需要传统上用来携带DNA进入细胞的病毒递送系统。相关研究结果于2022年8月25日在线发表在Nature Biotechnology期刊上,论文标题为“High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails”。

论文共同通讯作者Alexander Marson博士说,“多年来,我们的目标之一是以一种不依赖病毒载体的方式将冗长的DNA指令引入基因组中的靶位点上。这是迈向下一代安全和有效的细胞疗法的一大一步。”
在这篇论文中,Marson和他的同事们不仅描述了这项技术,还展示了它如何被用来构建具有抗击多发性骨髓瘤(一种血癌)潜力的CAR-T细胞,以及改写发生突变后可能导致罕见的遗传性免疫疾病的基因序列。
论文共同通讯作者、Marson实验室临床研究员Brian Shy博士说,“我们发现我们可以在一次运行中对超过10亿个细胞进行基因改造,这远远超过了我们治疗一名患者所需的细胞数量。”
从双链DNA到单链DNA
CRISPR-Cas9是一种在活细胞内进行基因编辑的系统,在过去十年中一直被用作基础研究工具。越来越多的临床科学家对利用CRISPR-Cas9开发活细胞疗法的潜力感到兴奋。通过基因编辑,人们可以关闭、剔除或替换发生突变的、致病的基因,或提高免疫细胞的抗癌活性,等等。虽然CRISPR-Cas9的第一种治疗性应用最近已进入临床试验,但该技术仍然受到安全制造大量正确编辑的细胞这一挑战的限制。
传统上,科学家们依靠病毒载体---没有致病成分的病毒外壳,将用于基因治疗的DNA(称为DNA模板)携带到细胞中。然而,制造大量的临床级病毒载体一直是将细胞疗法带给患者的主要瓶颈。此外,人们不能轻易控制传统病毒载体在基因组内插入基因的位置。
Shy说,“使用病毒载体是成本昂贵和需要大量资源。非病毒基因工程方法的一个主要好处是,我们不像以前那样受到成本、制造复杂性和供应链挑战的限制。”
2015年,Marson团队与CRISPR先驱Jennifer Doudna博士的实验室合作,首次表明他们在利用电场使细胞的外膜更加通透的情形下,可以在没有病毒载体的情况下将短的DNA模板插入免疫细胞。2018年,他们开发了一种用CRISPR将较长的DNA序列递送到免疫细胞中的方法(Nature , 2018, doi:10.1038/s41586-018-0326-5)。
然后,在2019年,Marson团队发现,通过同时使用能够与Cas9酶---在CRISPR基因编辑过程中充当分子剪刀的蛋白---结合的改良版DNA模板,他们可以更有效地将新序列递送到基因组中的靶位点(Nature Biotechnology, 2019, doi:10.1038/s41587-019-0325-6)。
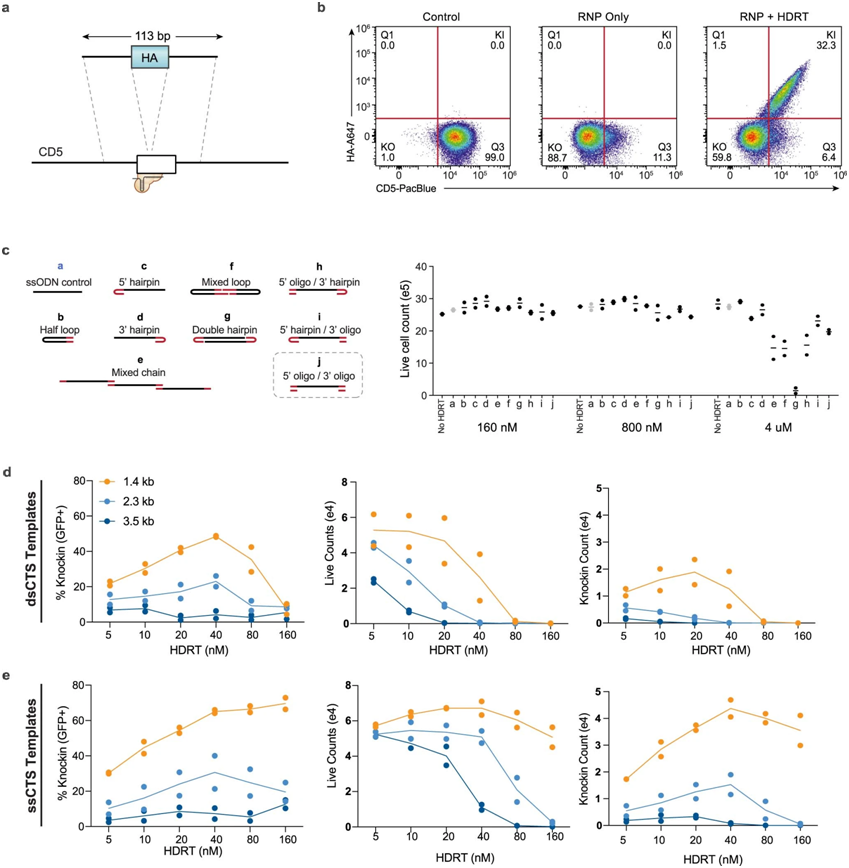
CTS(Cas9 target sequence,Cas9靶序列)模板设计的比较,图片来自Nature Biotechnology, 2022, doi:10.1038/s41587-022-01418-8。
然而,还需开展更多的研究工作,以提高成功接受基因改造的免疫细胞的产量,并使该过程与未来的细胞疗法的制造兼容。这些目标促进了Marson团队开展这项新的研究。
DNA可以以单链或双链形式存在,而Cas9会附着在双链DNA上。这些作者很快发现,高水平的双链DNA模板对细胞有毒,因此该方法只能用于低量的模板DNA,这会导致编辑效率低下。
Marson团队知道单链DNA对细胞的毒性较小,即使在相对高的浓度下也是如此。因此,在这篇新的论文中,他们描述了一种将改良的Cas9酶附着在单链DNA模板上的方法,只需在两端添加一小段悬空的双链DNA。Marson说,“这给了我们一种平衡的、两全其美的方法。”
与传统的双链DNA模板相比,单链DNA模板可以使基因编辑的效率提高一倍以上。单链DNA分子的双链末端让人们可以使用Cas9来加强非病毒载体在细胞中的递送。
论文共同作者、加州大学旧金山分校实验室医学助理教授Jonathan Esensten博士说,“这项技术有可能使新的细胞疗法和基因疗法更快、更好、更便宜。”
通往临床的道路
在这项新的研究中,这些作者使用新的DNA模板产生了超过10亿个靶向多发性骨髓瘤的CAR-T细胞。CAR-T细胞是经过基因改造的T细胞,可以有效对抗特定的细胞或癌症。有了新的由Cas9指导的单链模板,大约一半的T细胞获得了新的基因,因而被转化为CAR-T细胞。
论文共同作者、加州大学旧金山分校血液学与肿瘤学科医学助理教授Justin Eyquem博士说,“我们知道,将DNA模板靶向基因组中称为TRAC(T-cell receptor α constant, T细胞受体α恒定区)位点的特定位点,将会提高CAR-T细胞的抗肿瘤效力。这种新的非病毒方法使我们能够更有效地实现这一目标,这将加快下一代CAR-T细胞疗法的开发。”
此外,这些作者发现他们的方法首次可以完全替换与罕见遗传性免疫疾病相关的两个基因,即IL2RA和CTLA4基因。
在过去,科学家们已发现他们可以替换IL2RA基因中特定患者发生突变的较小部分。如今,Marson团队证实他们可以一次性替换整个IL2RA和CTLA4基因---一种“一体适用”的方法,可以治疗这些基因发生不同突变的许多患者,而不必为每名患者的突变构建个性化的DNA模板。用这种基因工程方法处理的T细胞中,近90%获得了健康版本的基因。
Marson团队如今正在寻求批准,以推进在CAR-T细胞治疗和IL2RA缺乏症治疗中使用非病毒CRISPR技术的临床试验。(生物谷 Bioon.com)
参考资料:
1. Brian Shy et al. High-yield genome engineering in primary cells using a hybrid ssDNA repair template and small-molecule cocktails. Nature Biotechnology, 2022, doi:10.1038/s41587-022-01418-8.
2. A Cellular Engineering Breakthrough: High-Yield CRISPR Without Viral Vectors
https://gladstone.org/news/cellular-engineering-breakthrough-high-yield-crispr-without-viral-vectors
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


