复旦附属华山医院团队破解胆汁酸诱导肝癌免疫逃逸之谜
来源: 奇点糕 2022-04-29 09:37
肝细胞癌(HCC)是一种恶性程度很高的肿瘤,根据中国国家癌症中心最新数据,肝癌(主要是HCC)位居癌症死亡率排名第二位[1],给我国人民带来了极大的健康负担。
肝细胞癌(HCC)是一种恶性程度很高的肿瘤,根据中国国家癌症中心最新数据,肝癌(主要是HCC)位居癌症死亡率排名第二位[1],给我国人民带来了极大的健康负担。我们迫切需要了解肝癌的发病机制并开发更有效的治疗策略。
肝脏由于其独特的位置与血供,会接触到大量来自肠道的食物抗原以及微生物抗原,为了维持机体的稳态,避免过度炎症,肝脏必须在免疫应答与耐受之间维持平衡。若这种平衡被打破则有可能引起炎症、感染或者肿瘤[2,3]。
同时,肝脏也是一个代谢活跃的器官。例如,肝脏是胆汁酸代谢的中心枢纽,胆汁酸不仅对于脂质的吸收代谢具有重要作用,还能作为内分泌信号分子调节多种生物过程,其中就包括免疫反应[4]。但是目前我们并不清楚肝脏的新陈代谢会如何影响肿瘤的发生与发展。
近日,由复旦大学附属华山医院的叶丹教授、王璞副教授和中山医院的史颖弘副教授领衔的研究团队在Journal of Hepatology期刊发表研究成果[5]。
他们发现人HCC组织中SIRT5的表达显著下调,并且SIRT5的低表达与患者的不良预后相关。这是由于缺乏SIRT5会引起初级胆汁酸增加,而胆汁酸可以促进巨噬细胞M2极化,营造了免疫抑制的微环境,有利于HCC的发生发展。
好消息是,利用临床常用药物消胆胺(CHO)可以螯合胆汁酸,逆转巨噬细胞的M2极化,抑制HCC的生长。

论文首页截图
研究人员分析公共数据库以及临床数据发现,SIRT5在HCC组织中显著下调,并且SIRT5的低表达与HCC患者生存期较短相关。这提示SIRT5可能具有抑制肿瘤的作用。
由于60%以上的HCC都表现出癌基因YAP表达上调,因此,研究人员依据YAP的靶基因CTGF和CYR61的表达,将TCGA数据集中HCC患者数据分为YAP-ON与YAO-OFF两组,发现SIRT5的表达在YAP-ON的患者中与生存期呈正相关,而在YAP-OFF患者中则没有这种相关性。这些数据提示,SIRT5的下调可能与癌基因协同促进HCC的发生发展。
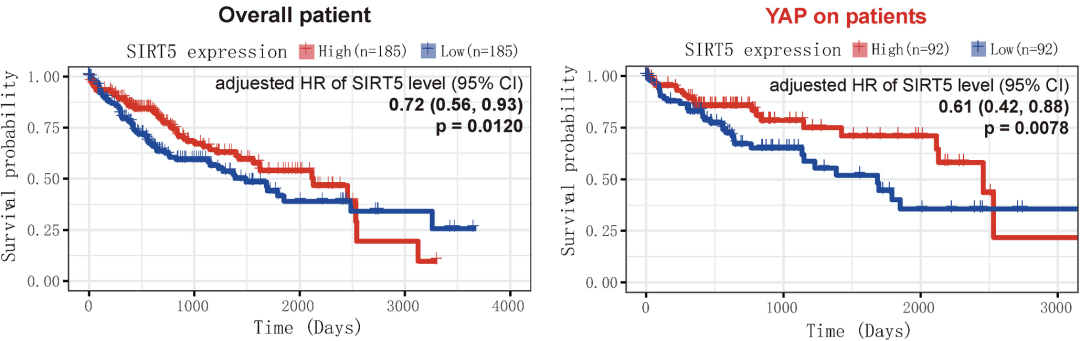
SIRT5表达下调与HCC患者不良预后相关
为了在体内研究SIRT5在HCC发病中扮演的角色,研究人员通过尾静脉高压注射的方式,将包含癌基因YAP5SA或AKT1/NRasG12V的质粒导入WT小鼠或者SIRT5-/-小鼠肝脏,构建了小鼠肝癌模型。实验发现,与WT小鼠相比,SIRT5-/-小鼠的肿瘤数量更多,尺寸更大,小鼠生存期更短。这些数据表明,SIRT5的缺失与癌基因协同促进HCC的发生发展。
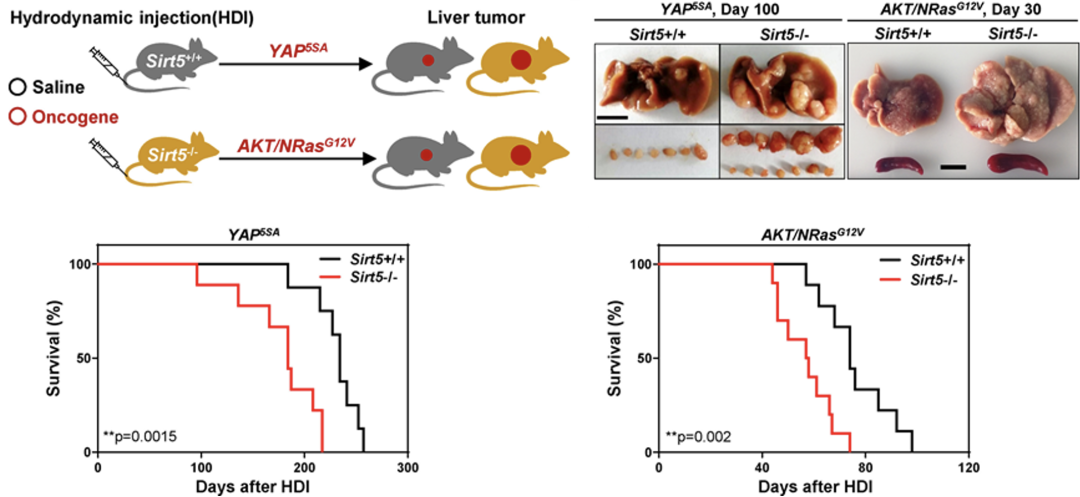
SIRT5缺陷与癌基因协同促进HCC发生发展
为了进一步明确肝实质细胞SIRT5缺陷与癌基因表达是导致HCC发生发展的原因。研究人员在单个转座子中同时插入YAP5SA和针对SIRT5的shRNA元件,通过高压注射将构建的载体转入WT小鼠的肝实质细胞,发现在肝实质细胞中转入癌基因的同时敲低SIRT5的表达,会促进HCC的发生,并缩短小鼠的生存期。
另一方面,如果向SIRT5-/-小鼠肝实质细胞导入YAP5SA以及SIRT5过表达质粒,则显著抑制了HCC的发生,延长小鼠的生存期。
这些结果说明,肝细胞(而不是其他类型的细胞)中的SIRT5缺陷可以协同癌基因促进HCC的发生发展。
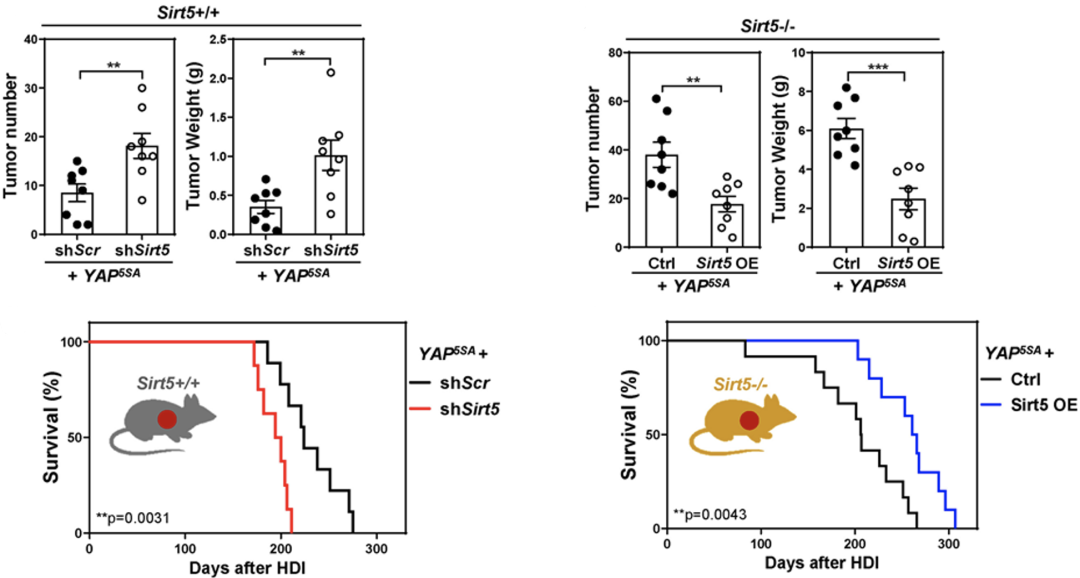
肝细胞中SIRT5缺陷协同癌基因促进HCC发生发展
为了探究SIRT5在HCC发生中的作用机制,研究人员开展了进一步的研究,通过细胞系实验他们发现,SIRT5缺陷并不影响肿瘤细胞本身的增殖、迁移能力。这排除了SIRT5缺陷通过增强肝细胞成瘤能力促进HCC发生的可能性。
那么SIRT5缺陷是通过怎样的机制促进肿瘤发生的呢?研究团队分析了肿瘤微环境中的免疫细胞组成发现,SIRT5-/-小鼠肝脏中M2极化巨噬细胞以及MDSC数量显著增加,而CD8+T细胞的数量显著减少。这提示SIRT5的缺陷创造了有利于肿瘤发生发展的免疫抑制微环境。

SIRT5缺陷促进M2巨噬细胞数量增加
由于SIRT5的底物包括多种与代谢相关的酶,因此研究人员对高压注射了YAP5SA的SIRT5-/-和WT小鼠肝脏进行了代谢组学分析。结果发现SIRT5-/-小鼠肝脏胆汁酸生物合成通路上调。虽然SIRT5-/-小鼠肝脏总胆汁酸的含量没有显著变化,但是其中T-CA(胆汁酸和胆酸与牛磺酸结合产物)在胆汁酸中的比例显著升高,并且SIRT5-/-小鼠血清中T-CA的浓度也显著高于WT小鼠。
为了探究SIRT5缺陷是否通过T-CA影响肿瘤微环境,研究人员进行了体外共培养实验以及巨噬细胞极化实验,发现T-CA可以促进巨噬细胞M2极化,并且这种作用依赖于T-CA的核受体FXR。这些数据表明,SIRT5缺陷的肝细胞可以通过增加T-CA的含量促进巨噬细胞M2极化。

SIRT5缺陷促进T-CA增加并促进巨噬细胞M2极化
既然T-CA能够引起免疫抑制,促进HCC发生发展,那么中和T-CA是否能够逆转免疫抑制,从而抑制肿瘤生长呢?
为了搞清楚这个问题,研究人员使用临床常用的消胆胺治疗导入YAP5SA的小鼠。消胆胺治疗不仅有效地降低小鼠肝脏以及血清中的T-CA水平,同时也显著减少了SIRT5-/-小鼠(而不是SIRT5+/+小鼠)肿瘤中MDSC以及M2极化的巨噬细胞数量,并且减少了肿瘤结节数量与重量。这说明使用消胆胺螯合T-CA能够有效逆转MDSC与M2极化巨噬细胞引起的免疫抑制,抑制肿瘤生长。
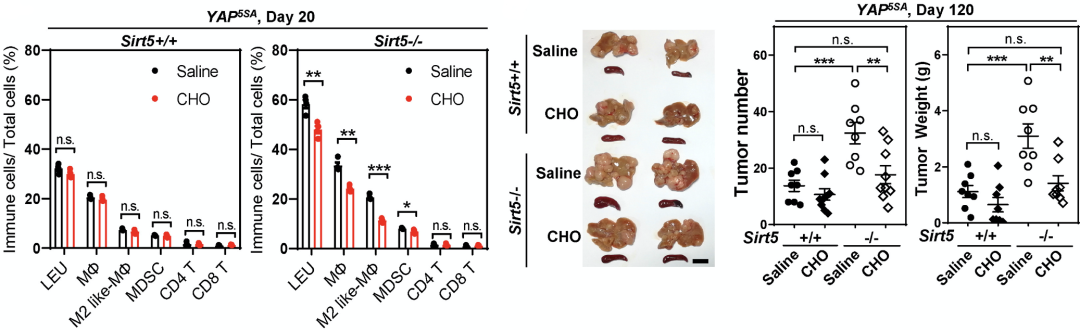
消胆胺治疗逆转免疫抑制并减轻肿瘤负荷
以上的研究结果在小鼠中揭示了SIRT5缺陷增加肝脏以及血清T-CA水平,T-CA促进巨噬细胞M2极化引起免疫抑制促进肿瘤生长的机制。为了探究同样的机制是否存在于人类HCC患者中,研究人员分析了TCGA数据库中HCC患者转录组数据以及HCC患者临床标本,发现SIRT5基因表达量与TAM、M2巨噬细胞标志基因呈显著负相关。
并且相比于健康人,HCC患者血清T-CA水平显著增高,并且血清高T-CA与肿瘤局部TAM、M2巨噬细胞数量存在正相关。这些数据说明,在小鼠中发现的机制同样存在与HCC患者中。
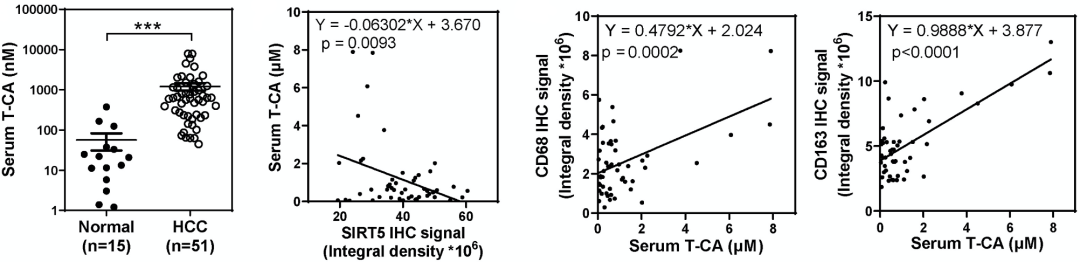
HCC患者血清T-CA浓度与M2巨噬细胞标志物呈正相关
总的来说,这项研究成果揭示了在HCC中,SIRT5的低表达增加T-CA含量,进而导致肿瘤免疫逃逸的机制,同时也提出使用已经获批的消胆胺治疗HCC患者的潜在治疗策略,这对于SIRT5低表达或血清高水平T-CA的HCC患者来说具有重要意义。期待有进一步的临床试验探究消胆胺对HCC的治疗作用,从而为广大HCC患者带来希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


