Cell Discov | 冷冻电镜揭示的SRCAP复合体与核小体结合的高分辨率结构
来源:生物探索 2024-02-15 10:49
该研究测定了核小体结合的SRCAP-C在不同核苷酸结合状态下的结构,并进行了结构引导染色质免疫沉淀测序(ChIP-seq)分析,以测试ZNHIT1对H2A.Z在体内掺入的影响。
复旦大学徐彦辉及Wang Li共同通讯在Cell Discovery(IF 33.5)在线发表题为“Structural insights into histone exchange by human SRCAP complex”的研究论文,该研究确定了人类SRCAP-C与含H2A的核小体结合的结构。

在真核细胞中,基因组DNA包裹在组蛋白八聚体周围,在基因组上产生排列的核小体。典型核小体包含四个组蛋白H2A、H2B、H3和H4的两个拷贝。为了实现功能调节,ATP依赖性染色质重塑复合体(重塑复合体)改变核小体的组成和沿DNA的位置。染色质重塑复合物根据其催化ATP酶的异同可分为4个家族:模仿开关(ISWI)、染色质结构域解旋酶DNA结合(CHD)、开关/sucrose不可发酵(SWI/ SNF)和肌醇营养不良80 (INO80)。其中两种重塑蛋白由单个亚基(CHD家族)或几个亚基(ISWI家族)组成。相比之下,SWI/SNF和INO80家族是多亚基复合物,除了超家族II解旋酶样运动亚基外,还含有肌动蛋白和肌动蛋白相关蛋白(ARPs)以及其他具有不同功能的重塑蛋白特异性亚基。
人类染色质重塑子SNF2相关CPB激活蛋白(SRCAP)复合物(SRCAP-C)及其酵母对应物SWR1复合物(SWR-C)属于INO80染色质重塑子家族。SRCAP-C和SWR-C可以用H2A.Z-H2B二聚体以ATP依赖的方式取代H2A-H2B二聚体,这一过程可能需要组蛋白伴侣。生成的H2A.Z含核小体富集于几乎所有常染色质基因的启动子区域,并参与转录和其他过程的调控,如DNA复制、DNA修复和染色体分离。
在真核细胞中,H2A.Z主要存在于它位于启动子的远端,在RNAPII的起始和延伸中起关键作用。H2A.Z在复制起点也广泛富集,并通过调节早期复制起点的起始和复制时间与DNA复制直接相关。此外,研究表明,协调H2A.Z双链断裂(DSBs)中的动力学对DNA修复至关重要。H2A.Z在染色体分离过程中也起着至关重要的作用,以维持基因组处于稳定状态。与其他染色质重塑子不同,SWR-C与核小体结合并诱导DNA展开和重新包裹,但不产生净DNA易位,表现出一种典型特征。
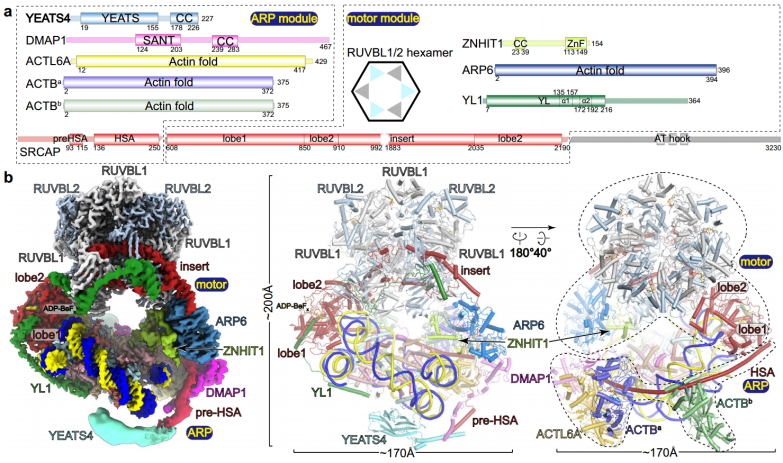
核小体结合的SRCAP-C的整体结构(Credit: Cell Discovery)
人SRCAP-C是一种~1-MDa复合物,由SRCAP、YL1、RUVBL1、RUVBL2、ARP6、ZNHIT1、DMAP1、ACTL6A、ACTB和YEATS4等10个亚基组成,酵母SRCAP-C由10个相同的亚基组成,分别为Swr1、Swc2、RvB1、RvB2、ARP6、Swc6、Swc4、Arp4、Actin、Yaf9和另外4个酵母特异性亚基Swc3、Swc5、Swc7和Bdf1。先前的研究已经揭示了酵母SWR-C、人SRCAP-C和核小体结合酵母SWR-C在ATP类似物ADP-BeFx存在下的结构。SWR-C含有RuvBL蛋白的异六聚体,Swr1中的插入物通过RuvBL六聚体延伸。Swr1的ATP酶结构域在超螺旋位置(SHL) 2上抓住DNA,导致DNA在ADP-BeFx结合状态下移位1bp。此外,进入DNA部分被解开,组蛋白核心“弯曲”。与酵母SWR-C相比,SRCAP-C采用了大致相似的结构,包含一个带有两个独立臂的环状“头”。
该研究测定了核小体结合的SRCAP-C在不同核苷酸结合状态下的结构,并进行了结构引导染色质免疫沉淀测序(ChIP-seq)分析,以测试ZNHIT1对H2A.Z在体内掺入的影响。SRCAP-C介导的Z交换。SRCAP亚基集成了一个6亚基肌动蛋白相关蛋白(ARP)模块和一个含ATP酶的马达模块。ATP酶相关的ARP模块沿DNA包围核小体的一半,并可能抑制净DNA易位,这是SRCAP-C的独特特征。motor模块在载脂蛋白(无核苷酸)、ADP结合和ADP-BeFx结合状态下采用不同的核小体结合模式,表明ATP酶驱动的运动通过解开进入DNA的包裹使H2A-H2B不稳定,并通过ZNHIT1亚基将H2A-H2B拉出核小体。结构导向的染色质免疫沉淀测序分析证实了H2A接触ZNHIT1维持H2A.Z基因组上占用率的必要性。该研究为SRCAP-C介导的H2A-H2A.Z交换机制提供了结构性的见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


