Cell:李晓淳研究组揭示磷脂酰丝氨酸合成及其抑制从而促进LDL吸收的分子机制
来源:生物探索 2024-09-02 08:55
本研究阐述了通过调控磷脂代谢来控制胆固醇吸收的概念,为开发新型降胆固醇药物提供了理论依据。
磷脂酰丝氨酸(PS)是细胞膜中最丰富的带负电荷的磷脂,在细胞膜结构、细胞凋亡、血液凝固和病毒感染等生理过程中发挥关键作用。在哺乳动物细胞中,PS的生合成发生在内质网中,磷脂酰丝氨酸合成酶(包括PSS1和PSS2)通过钙离子依赖的方式利用丝氨酸将磷脂酰胆碱(PC)或磷脂酰乙醇胺(PE)的极性头基替换,生成PS【1】。PSS1的功能获得性突变会显著增加PS的产量,并引起名为Lenz-Majewski综合症(LMS)的罕见遗传病,其特征包括智力障碍和骨骼发育不良【2】。最新研究表明,PSS1特异性抑制剂在PTDSS2缺乏的癌症和B细胞淋巴瘤的治疗中显示出潜在的应用价值【3,4】。低密度脂肪蛋白(LDL)通常被称做“坏”胆固醇,LDL在血液中的积累会引发心脑血管疾病和中风。
目前,关于治疗高血脂的药物主要作用在增加细胞表面的LDL受体,提高LDL的吸收来减少其在血液中的积累。2020年,1985年诺贝尔奖生理学或医学奖得主Mike Brown 和Joe Goldstein的研究组发现PSS1调控LDL中的胆固醇从细胞膜转运至内质网的过程,其缺失会导致胆固醇在细胞膜上的积累【5,6】。关于PSS1催化PS合成的分子机制、特异性抑制剂的作用机制以及其在LDL代谢调控中的作用仍然不明确。2024年8月28日,美国德州大学西南医学中心李晓淳研究组在Cell杂志上发表了题为Molecular insights into Human phosphatidylserine synthases 1 reveal its inhibition promotes LDL uptake的研究论文。该研究首次报告了人源PSS1的2.7 Å分辨率的冷冻电镜结构。

PSS1包含10个跨膜螺旋呈现出此前未报道过的拓扑结构。其第1至3和9个跨膜螺旋参与形成二聚化界面,第4至8个跨膜螺旋在内质网腔内侧参与形成催化活性中心,并在其中观察到了内源的底物PE和钙离子。此外,在活性中心的另一侧观察到了两个PS的结合位点,这些位点与LMS致病性功能获得性突变(L265P和P269S)相关。功能研究和分子动力学模拟表明,PS通过变构调节的方式抑制PSS1的催化活性。通过对突变体P269S的结构分析表明,在无PS结合的情况下,PSS1会发生构象变化使得底物磷脂和丝氨酸更容易进入催化活性中心。进一步功能研究表明PSS1利用催化残基组氨酸来激活被钙离子稳定的丝氨酸来完成磷脂头的交换反应。这个反应机理与其研究组发现的MBOAT家族的催化机制类似【7,8】。
通过对PSS1与其特异性抑制剂DS55980254复合物结构的解析,作者观察到抑制剂结合在催化中心旁边的口袋。序列比对分析和分子模拟等实验阐明了抑制剂的特异性和与PS类似的变构调节机理。他们的研究进一步揭示,PSS1缺失会导致内质网胆固醇浓度下降,导致SREBP-2途径的激活。细胞实验表明PSS1抑制剂能够显著提高细胞表面LDLR的数量,从而促进LDL的摄取。与目前广泛应用于临床的他汀类药物不同,DS55980254不会抑制胆固醇合成酶羟甲基戊二酸单酰辅酶A(HMGCR)的活性,也不会导致HMGCR在内质网的积累,有可能避免他汀药物所产生的副作用。由于细胞中还广泛存在PSS2,特异性抑制PSS1的活性也不会导致细胞因PS缺失而死亡。这些发现阐述了通过调控磷脂代谢来控制胆固醇吸收的概念,为开发新型降胆固醇药物提供了理论依据。
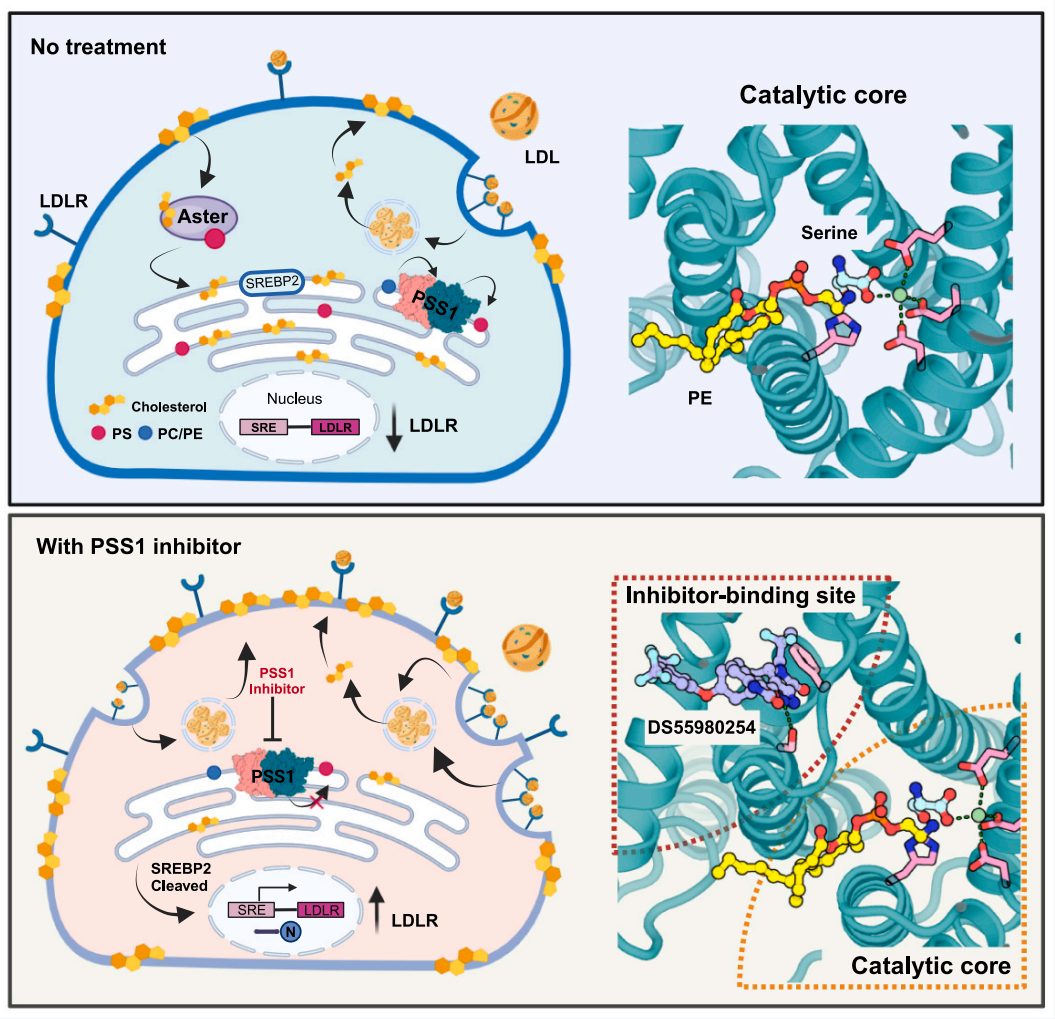
模式图(Credit: Cell)
1. J. E. Vance, Historical perspective: phosphatidylserine and phosphatidylethanolamine from the 1800s to the present. Journal of lipid research 59, 923-944 (2018).
2. S. B. Sousa et al., Gain-of-function mutations in the phosphatidylserine synthase 1 (PTDSS1) gene cause Lenz-Majewski syndrome. Nature genetics 46, 70-76 (2014).
3. J. Omi et al., Phosphatidylserine synthesis controls oncogenic B cell receptor signaling in B cell lymphoma. The Journal of cell biology 223, (2024).
4. Y. Yoshihama et al., Potent and Selective PTDSS1 Inhibitors Induce Collateral Lethality in Cancers with PTDSS2 Deletion. Cancer research 82, 4031-4043 (2022).
5. M. N. Trinh et al., Interplay between Asters/GRAMD1s and phosphatidylserine in intermembrane transport of LDL cholesterol. Proceedings of the National Academy of Sciences of the United States of America 119, (2022).
6. M. N. Trinh et al., Last step in the path of LDL cholesterol from lysosome to plasma membrane to ER is governed by phosphatidylserine. Proceedings of the National Academy of Sciences of the United States of America 117, 18521-18529 (2020).
7. T. Long, Y. Sun, A. Hassan, X. Qi, X. Li, Structure of nevanimibe-bound tetrameric human ACAT1. Nature 581, 339-343 (2020).
8. Y. Liu et al., Mechanisms and inhibition of Porcupine-mediated Wnt acylation. Nature 607, 816-822 (2022).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


