已现3例死亡!阿尔茨海默症“神药”安全性再度遭疑
来源:生物探索 2023-01-03 11:13
作为一种神经系统退行性疾病,阿尔茨海默症常发于老年群体。由于该病为脑内发生病变,患者通常会伴随着记忆丧失和认知技能衰退,出现行为偏差,并将逐渐丧失适应社会生活的能力。
作为一种神经系统退行性疾病,阿尔茨海默症常发于老年群体。由于该病为脑内发生病变,患者通常会伴随着记忆丧失和认知技能衰退,出现行为偏差,并将逐渐丧失适应社会生活的能力。阿尔茨海默症起病隐匿,发病过程没有较为明显的典型症状,正因如此极其容易被忽视。
阿尔茨海默症主要表现为认知功能和行为障碍及精神异常等症状,是继心脑血管疾病和恶性肿瘤之后,老年人致残、致死的第三大疾病,已经成为一种日益严重的全球性健康危机。根据世界阿尔茨海默症2020年报告公布数据,目前全球约有5000万人患有该病,同时患病率还在不断上升,预计到2050年,阿尔茨海默症患者将增加至1.5亿以上[1]。
遗憾的是,至今仍旧没有有效的治疗方案。在过去的20多年里,全球各大药企相继投入数千亿美元研发阿尔茨海默症治疗药物,加速开发有效的治疗药物成为医药领域的竞争焦点。
在这其中,卫材旗下的阿尔茨海默症新药lecanemab因试验数据亮眼,而被寄予极大厚望。但同时,这款药物的副作用也很明显,对于该药的安全性,人们保持观望态度。而自从2022年11月以来至今,该药已经导致两名患者死亡,总计共致三名患者死亡,至此,lecanemab前景不明。
12月21日,Science报道了lecanemab在临床试验中出现的第三例死亡案例,这名79岁妇女在接受lecanemab治疗后出现大面积脑肿胀、出血以及癫痫发作后于9月中旬死亡,文章题为“Scientists tie third clinical trial death to experimental Alzheimer’s drug”。

图1 文章截图(图源:[2])
lecanemab是一种人源化单克隆抗体,能够选择性结合以中和及清除可溶性毒性β淀粉样蛋白聚集体,这些聚集体被认为在阿尔茨海默症神经退行性变过程中发挥了重要作用。因此,lecanemab将会对疾病病理学产生影响,并减缓疾病进展。
今年9月27日,Biogen/卫材共同宣布,lecanemab治疗阿尔茨海默症的Ⅲ期临床(Clarity AD)达到临床主要终点和所有次要终点,在1795名参与者的大型全球临床研究中,具有高度统计学意义。试验结果显示,与安慰剂相比,接受治疗18个月后,lecanemab组患者认知衰退幅度减缓27%。在接受治疗6个月时,lecanemab组就与安慰剂组出现统计显著差别。所有关键次要终点也显示出高度统计学显著差异。
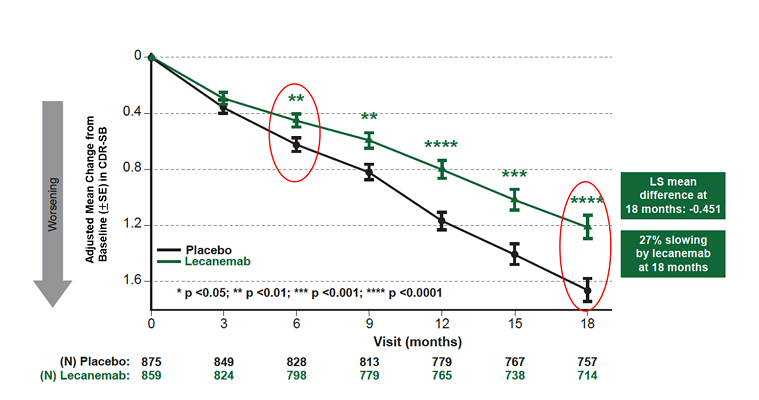
图2 主要终点临床痴呆综合评定量表变化值(18个月)(图源:[3])
值得警惕的是,lecanemab也有副作用,最明显的是在其他抗淀粉样药物治疗中出现的某些脑异常,包括脑肿胀和小出血。神经影像学检查发现,约21%的lecanemab治疗患者和9%的安慰剂治疗患者存在这些问题。虽然这些异常通常不会产生任何症状,但约3%的lecanemab患者确实有症状。
12月21日,lecanemab临床中出现了第3例死亡案例,根据Science显示,一名79岁的佛罗里达州妇女在经历了广泛的脑肿胀、出血以及癫痫发作后于9月中旬死亡,多位神经科学家认为,她的死很可能是由lecanemab引起的。卫材和Biogen没有在阿尔茨海默症会议上透露死亡人数,德比尔特大学神经学家和神经科学家 Matthew Schrag表示:“Eisai和Biogen未能披露这个案例,令人担忧并削弱了我对所报告的安全数据的完整性的信心”。
根据该名患者的医疗记录,其除了早期阿尔茨海默症的迹象外,没有明显的健康问题。在为期18个月的核心试验期间,该女性是否接受了抗体输注或安慰剂输注尚不清楚,但她确实在延长期6周内服用了药物,在延长试验开始前,脑部扫描显示有一些微出血的迹象,但还没有严重到将她排除在试验之外的程度。
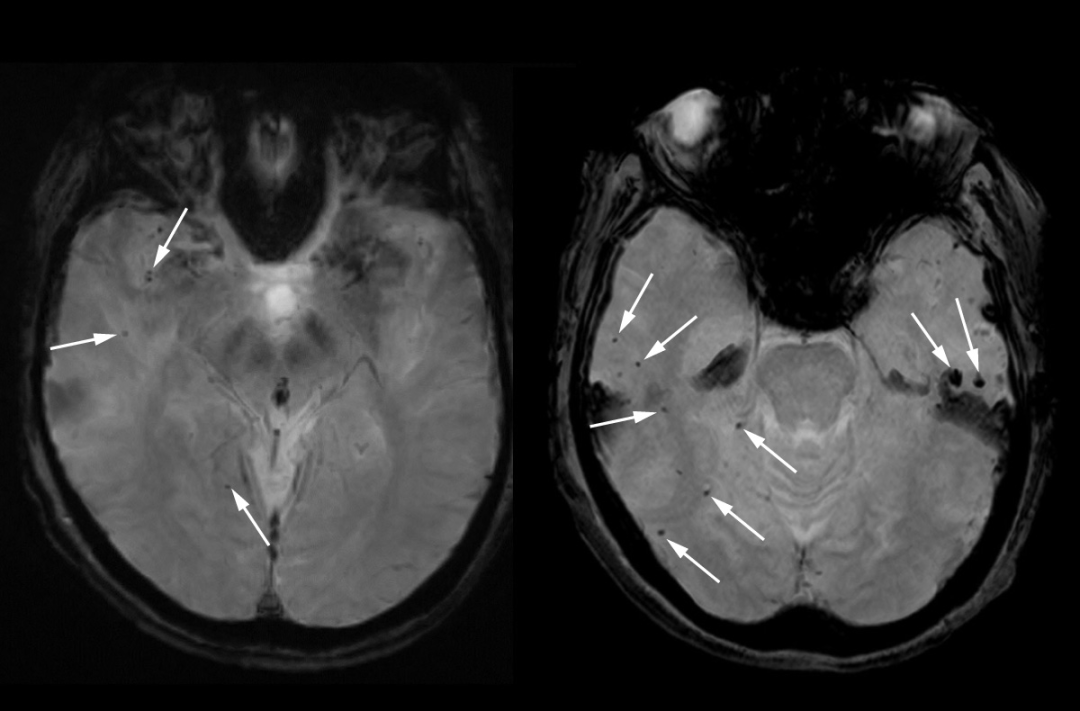
图3 接受Lecanemab治疗前,该名患者MRI扫描有些微出血(图源:[2])
波士顿大学神经病学家和神经科学家 Andreas Charidimou表示,脑部扫描显示数十个区域出血和脑肿胀非常广泛,以至于大脑皮层的特征性褶皱在她大脑的大部分区域“合并和挤压”。鉴于医疗记录中没有其他潜在的脑损伤原因,lecanemab 几乎可以肯定是罪魁祸首。
CAA专家施拉格说:“该患者的大脑出现广泛肿胀,并伴有一些小区域出血,导致她癫痫发作并最终死亡。我相信这是lecanemab的副作用。”
这不是个案,11月27日,Science报道了lecanemab临床中出现的第二例死亡,10月28日,STAT报道了lecanemab临床中出现的第一例死亡,至此,lecanemab临床中已经出现了三例死亡。
在Science报道之后,卫材表示它没有在11月的阿尔茨海默氏症会议上披露死亡事件,是因为迄今为止提供给卫材的信息并未表明ARIA 发生或被怀疑与死亡有关,并且因为目前尚未完成扩展试验的数据分析。
但不管怎样,这三例死亡事件无疑为lecanemab充满希望的试验结果蒙上了一层阴影,曾被寄予厚望的lecanemab如今安全性存疑,至于未来如何还有看其更进一步的有效性和安全性试验。
12月22日,卫材和Biogen宣布已向中国国家药品监督管理局提交lecanemab的上市申请。此前,lecanemab已分别于2021年6月和12月被FDA授予突破性疗法和快速通道指定。2022年7月,FDA在快速通道认定下接受了lecanemab的生物制品许可申请,并授予其优先审查权。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


