研究发现心外膜脂肪-交感相互作用诱发心律失常的新机制
来源:网络 2024-09-20 12:18
该研究通过建立共培养模型模拟心脏组织微环境,深入探讨心外膜脂肪相关心律失常的发生机理。研究结果表明,脂肪因子leptin激活交感神经,促使其分泌更高水平的NPY。
心律失常(Arrhythmia)影响着全球超过1200万人,且发病率也在不断上升,是心源性猝死的主要原因之一。心律失常诱发因素众多,研究表明交感神经系统(Sympathetic nervous system, SNS)活动异常和心外膜脂肪(Epicardial adipose tissue, EAT)增厚是心律失常发生的重要的独立风险因素。心外膜脂肪包绕着大部分心脏交感神经,两者特殊的位置关系提示心外膜脂肪和心交感神经之间的相互作用可能在心律失常发生中扮演重要的角色。然而,由于物种差异和伦理限制,目前尚无直接证据证明脂肪-交感神经相互作用参与心律失常的发生。
近日,中山大学中山医学院李伟强教授、项鹏教授团队、中山大学附属第三医院朱洁明教授团队和高州市人民医院朱秀龙教授团队合作在Cell Reports Medicine杂志上发表题为“The adipose-neural axis is involved in epicardial adipose tissue-related cardiac arrhythmias”的文章,成功揭示了心外膜脂肪-心交感神经在心律失常中的重要作用并解析了其作用机制。
该研究利用干细胞来源的心肌细胞、交感神经元和脂肪细胞建立了交感-心肌、脂肪上清-心肌、脂肪上清-交感-心肌等三种不同的共培养体系,检测这些共培养条件下心肌细胞的钙瞬变情况(钙瞬变是由兴奋冲动所诱发的心肌细胞胞质内瞬时性钙增高,是心肌细胞重要的Ca2+处理特性,与心肌细胞收缩节律密切相关)。
结果发现,心肌细胞与脂肪上清或交感神经共培养时,心肌细胞发生钙瞬异常的频率较未处理的心肌细胞无显著改变;然而,培养体系中同时加入脂肪上清和交感神经时(即三者共培养组),心肌细胞钙瞬变异常的发生频率明显高于其他两两共培养体系。同时,微电极阵列检测结果显示三者共培养组中,心肌细胞电传导模式改变,发生类似心律失常样改变。进一步研究发现,脂肪细胞因子leptin通过leptin受体激活SOCS3进而抑制JAK2/SATA3通路,促使交感神经分泌更高水平的神经递质。同时,该研究发现,交感神经主要依赖于神经肽Y(NPY)与Y1R的相互作用导致心肌细胞的节律异常。 临床数据进一步表明,心外膜脂肪增厚的房颤患者其冠状窦血清中NPY的含量远高于非心外膜脂肪增厚的房颤患者,且与房颤的严重程度呈正相关。
最后,研究人员探讨了NPY诱发心肌细胞节律异常的分子机制,发现三者共培养组的心肌细胞内钙/钙调蛋白依赖性蛋白激酶 II (CaMKⅡ)、钠钙交换体(NCX)活性升高,导致延迟后除极(DADs)增加,引起心肌细胞钙瞬变异常,产生心律失常样改变。而Y1受体抑制剂、CaMKⅡ抑制剂、NCX抑制剂可以有效阻断NPY的致心律失常作用。
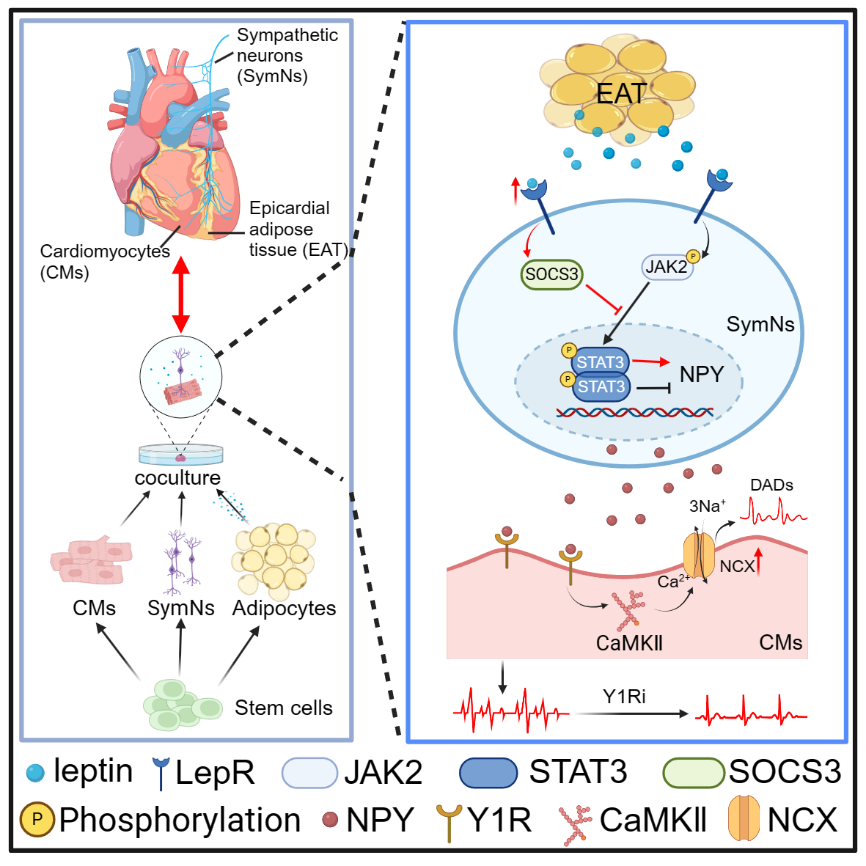
综上所述,该研究通过建立共培养模型模拟心脏组织微环境,深入探讨心外膜脂肪相关心律失常的发生机理。研究结果表明,脂肪因子leptin激活交感神经,促使其分泌更高水平的NPY。NPY通过Y1R受体引起心肌细胞内钙稳态异常,诱发心肌细胞心律失常样改变。抑制Y1R和下游钙信号相关蛋白可以有效阻断NPY的作用。该研究证实脂肪-神经轴参与心律失常的发生,为心律失常的治疗提供了潜在的新靶点。同时,也为研究EAT/ 交感神经系统相关疾病的发病机制、探索预防/治疗策略提供有力的工具。
中山大学中山医学院的李伟强教授、项鹏教授,中山大学附属第三医院朱洁明教授和高州市人民医院朱秀龙教授为共同通讯作者;团队成员范玉宝博士、黄珊珊博士和李苏华副主任医师为共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


