重磅!全球首款正式获批用于治疗阿尔茨海默病的β淀粉样蛋白抗体诞生
来源:代丝雨 2023-07-10 18:07
FDA正式批准Lecanemab(BAN2401)用于治疗成人阿尔茨海默病(AD)[1]。
FDA正式批准Lecanemab(BAN2401)用于治疗成人阿尔茨海默病(AD)[1]。Lecanemab曾于今年1月取得加速批准资格,此次基于Clarity AD(study 301)研究结果,FDA将加速审批转为正式审批。这是首款获得正式批准的用于治疗阿尔茨海默病的Aβ抗体药物。

Lecanemab(BAN2401)是人源化IgG1抗体,可选择性与较大的可溶性Aβ原纤维结合。曾有研究者横向对比了Lecanemab、Aducanumab和Gantenerumab对Aβ各种形式聚合物的结合能力,结果显示Lecanemab结合75-300kD较小原纤维的亲和力是Gantenerumab的10倍、Aducanumab的100倍;对于300-500kD的较大的原纤维,Lecanemab亲和力则是Aducanumab的25倍[2]。
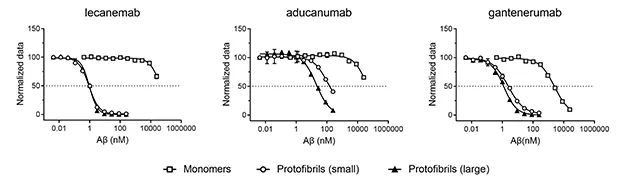
Lecanemab主要与Aβ原纤维结合
2022年11月29日,卫材公司在于旧金山召开的CATD大会上宣布了Lecanemab的3期临床研究Clarity AD的结果,论文同步登上《新英格兰医学杂志》(NEJM)。
Clarity AD是一项为期18个月的多中心双盲3期临床试验,纳入了1795名早期AD患者,即经正电子断层发射断层扫描(PET)或脑脊液证据确诊的AD相关轻度认知障碍或轻度痴呆患者。参与者随机分配至治疗组和安慰剂组,接受10mg/kg/双周静脉注射治疗,主要终点为CDR-SB评分较基线变化,次要终点为PET检测的淀粉样蛋白负荷变化和ADAS-cog14、ADCOMS、ADCS-MCI-ADL量表评分变化。
两组患者基线CDR-SB评分均为3.2,符合早期AD标准范围(0.5-6)。18个月时,治疗组CDR-SB评分为1.21,安慰剂组为1.66,绝对差值-0.45,评分下降延缓了27%。其他三项认知/行为评估结果也显示,Lecanemab带来了显著的改善。
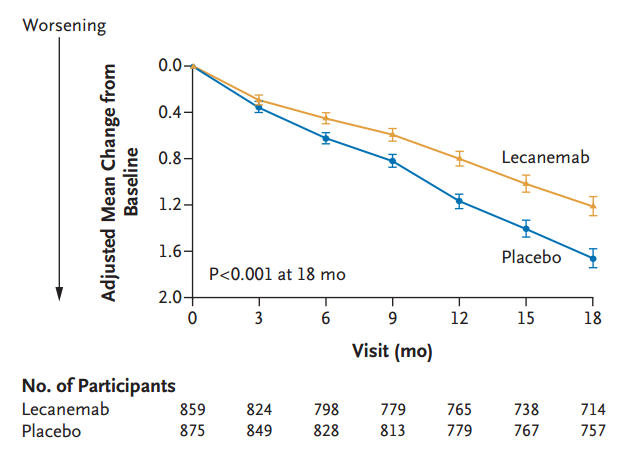
治疗组CDR-SB评分下降显著延缓
Lecanemab的安全性相对较好。治疗组中26.4%的患者出现了输液相关反应,12.6%出现了ARIA-E。ARIA-E中91%为轻度至中度,78%无症状,71%发生在治疗的前三个月,81%在发生4个月内消退。
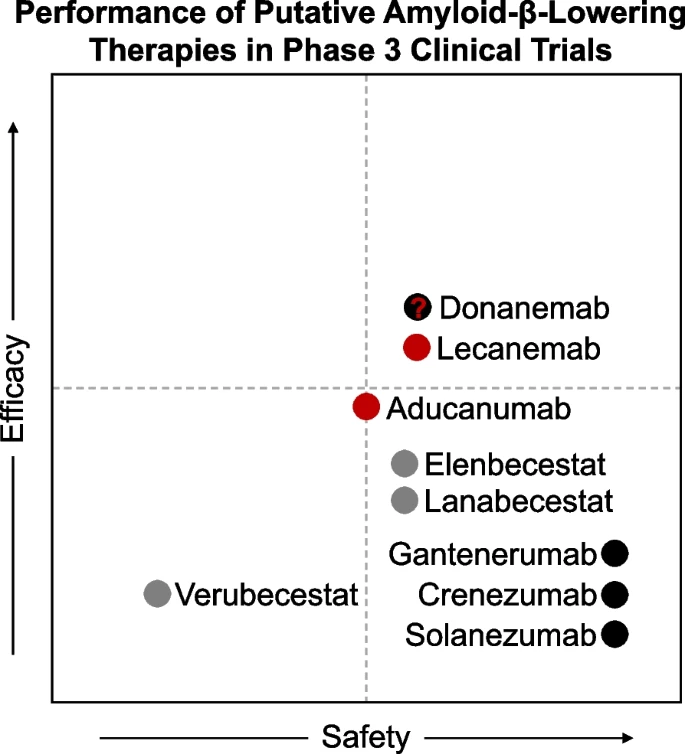
《BMC 分子神经退行性疾病》杂志于近日发表的评论文章[3]中对部分较受关注的AD新药的安全性和有效性进行了对比,可见Lecanemab二者皆相对较好。评论中也指出,Lecanemab在Clarity AD中表现出的疗效基本相当于治疗期间疾病相关进展延迟4-5个月。
Lecanemab的开发商卫材在今日发表声明[4],公布了Lecanemab在美国的定价措施。基于每双周一次10mg/kg的剂量,按照Study 201和Clarity AD中受试者的平均体重75kg,患者的年度医疗成本约为26500美元。考虑不同药品包装容量,这一数字可能略有波动。
他们还指出,在完成Aβ显著清除后,或可采取低剂量的维持给药方案,这能进一步降低医疗费用。
参考资料:
[1]https://www.fda.gov/news-events/press-announcements/fda-converts-novel-alzheimers-disease-treatment-traditional-approval
[2]https://www.alzforum.org/news/conference-coverage/lecanemab-sweeps-toxic-av-protofibrils-catches-eyes-trialists
[3]https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-023-00637-0
[4]https://www.prnewswire.com/news-releases/eisais-approach-to-us-pricing-for-leqembi-lecanemab-a-treatment-for-early-alzheimers-disease-sets-forth-our-concept-of-societal-value-of-medicine-in-relation-to-price-of-medicine-301715694.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


