JHO:高效抑制TGF-β和VEGF!华科同济医院团队揭示,创新双抗可与免疫治疗实现超级“强强联手”
来源:奇点糕 2023-08-22 14:43
这些分析都能说明,双抗Y332能够有效逆转肿瘤微环境的免疫抑制状态,乃至把肝癌这样“偏冷”的肿瘤变为“热肿瘤”,成为免疫治疗的强力搭档,那就期待它未来在临床研究中的表现吧。
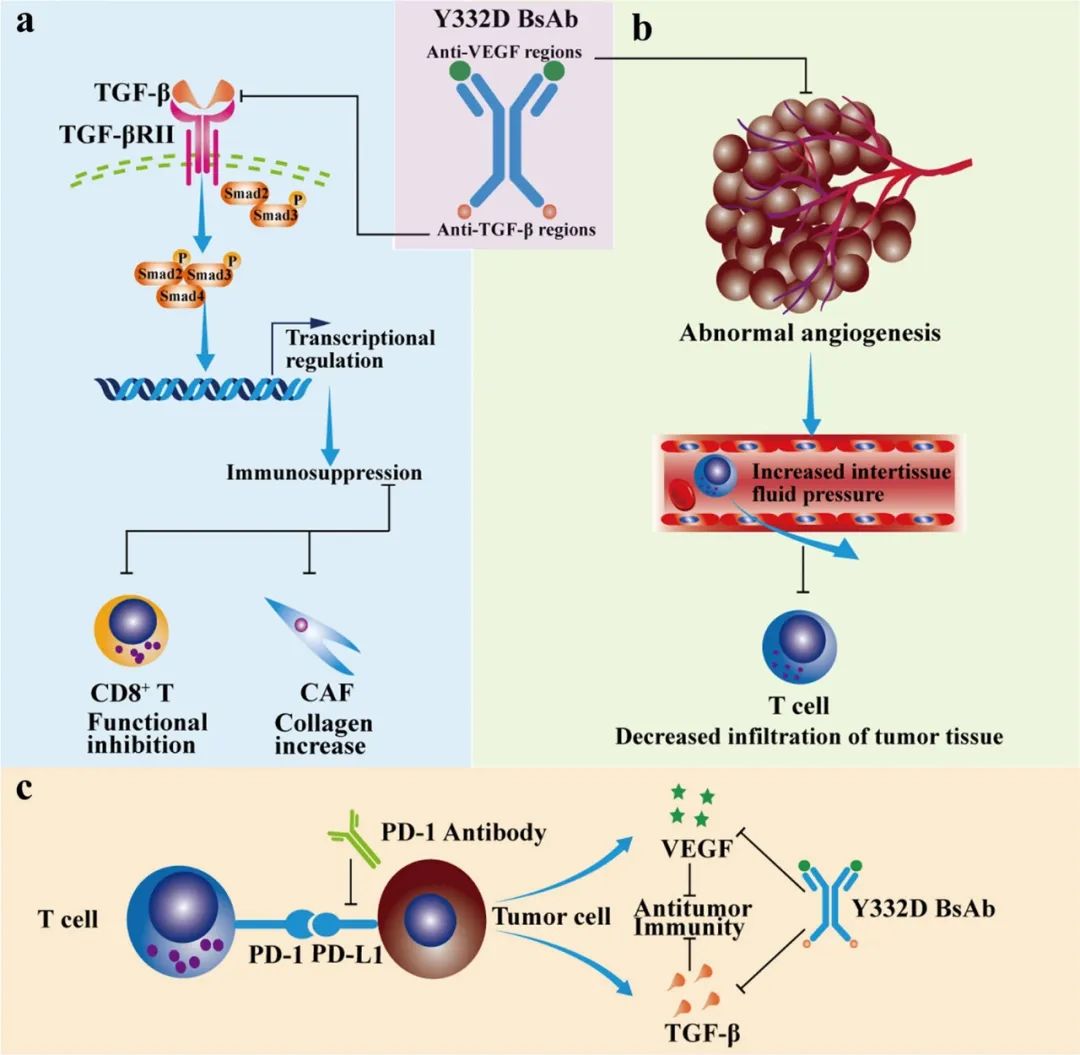
近日,华中科技大学同济医学院附属同济医院梅齐、褚倩和吴孔明团队在知名期刊Journal of Hematology & Oncology发文,证实Y332这款创新双抗可通过高效抑制TGF-β和VEGF,逆转免疫微环境抑制及癌细胞的上皮-间质转化(EMT)等过程,从而实现与PD-1抑制剂的高度协同增效、强力抑癌。

论文首页截图
关注免疫联合治疗的读者们,对VEGF促血管生成功效外的免疫抑制作用应该不会陌生,不然近些年免疫+抗血管方案也不会在肝癌等瘤种中连战连捷。TGF-β则暂时仍是“无药可用”的靶点,且它也能调节T细胞、NK细胞等免疫细胞亚群和肿瘤相关成纤维细胞(TAFs),强化肿瘤微环境免疫抑制状态。
因此用Y332双抗同时靶向VEGF和TGF-β,再与PD-1/L1抑制剂联合使用,就能在理论上实现“二石三鸟”。Y332属于对称型四价双特异性抗体,其制备是通过连接子将抗VEGF-IgG融合到抗TGF-β单域抗体的VHH区域实现的。
药效评价显示,Y332(研究论文中代号为Y332D)能够同时高度特异性地结合并抑制VEGF和TGF-β,达到了初步设计目标,接下来就该验证Y332能否有效逆转免疫抑制性微环境了。
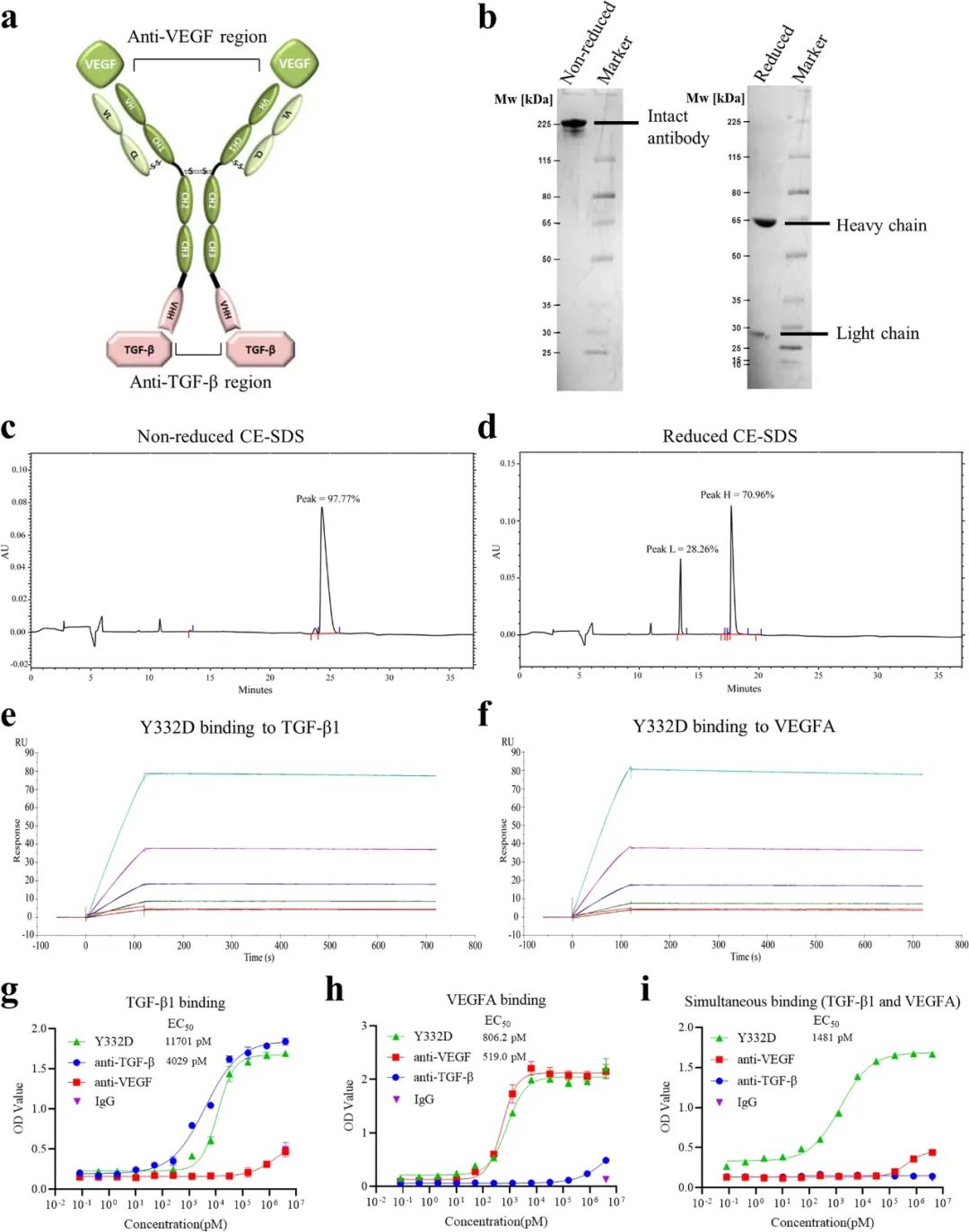
Y332结构示意图及其EC50
研究团队首先分析了Y332对TGF-β介导的免疫抑制作用如何:实验显示,Y332处理能够逆转TGF-β导致的T细胞增殖受限,以及T细胞激活期间的细胞因子分泌改变(如IL-2、IFN-γ分泌减少,IL-17A分泌增多)。
此外,TGF-β还可促进癌细胞的EMT、增强其侵袭和转移能力,而Y332也能有效拮抗TGF-β的促EMT作用,且减少EMT还可与抑制肿瘤新生血管形成、减少CAFs的作用实现协同。与TGF-β的免疫抑制作用相比,VEGF对免疫微环境的影响不易直接评估,但实验也证实Y332可有效抑制VEGF/VEGFR通路活性。
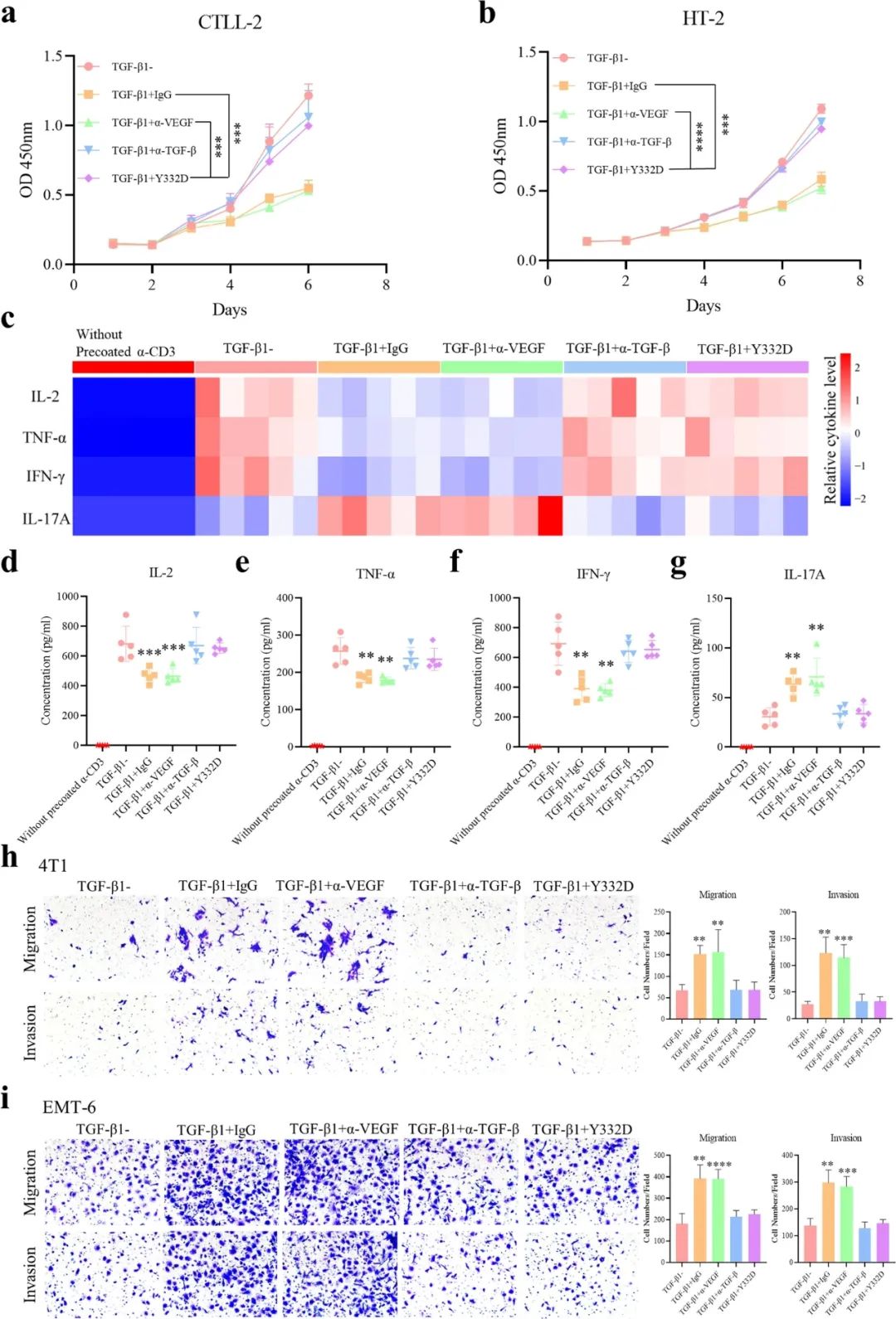
Y332可有效逆转TGF-β介导的免疫抑制
在肺癌、肝癌小鼠模型中的实验则显示,单纯抑制VEGF仅有一定的抗肿瘤活性、仅抑制TGF-β更是基本无效,但Y332作为双抗就体现出显著的抑癌效果,能有效减少肿瘤个数、同时抑制远处转移。
Y332与PD-1抑制剂联合用于肝癌小鼠时,更展现了明确的协同增效作用,缩瘤效果在研究者采用的各种单药或联合治疗方案中排名第一,明显优于PD-1抑制剂单药治疗,也优于抗VEGF或抗TGF-β单抗单独使用。
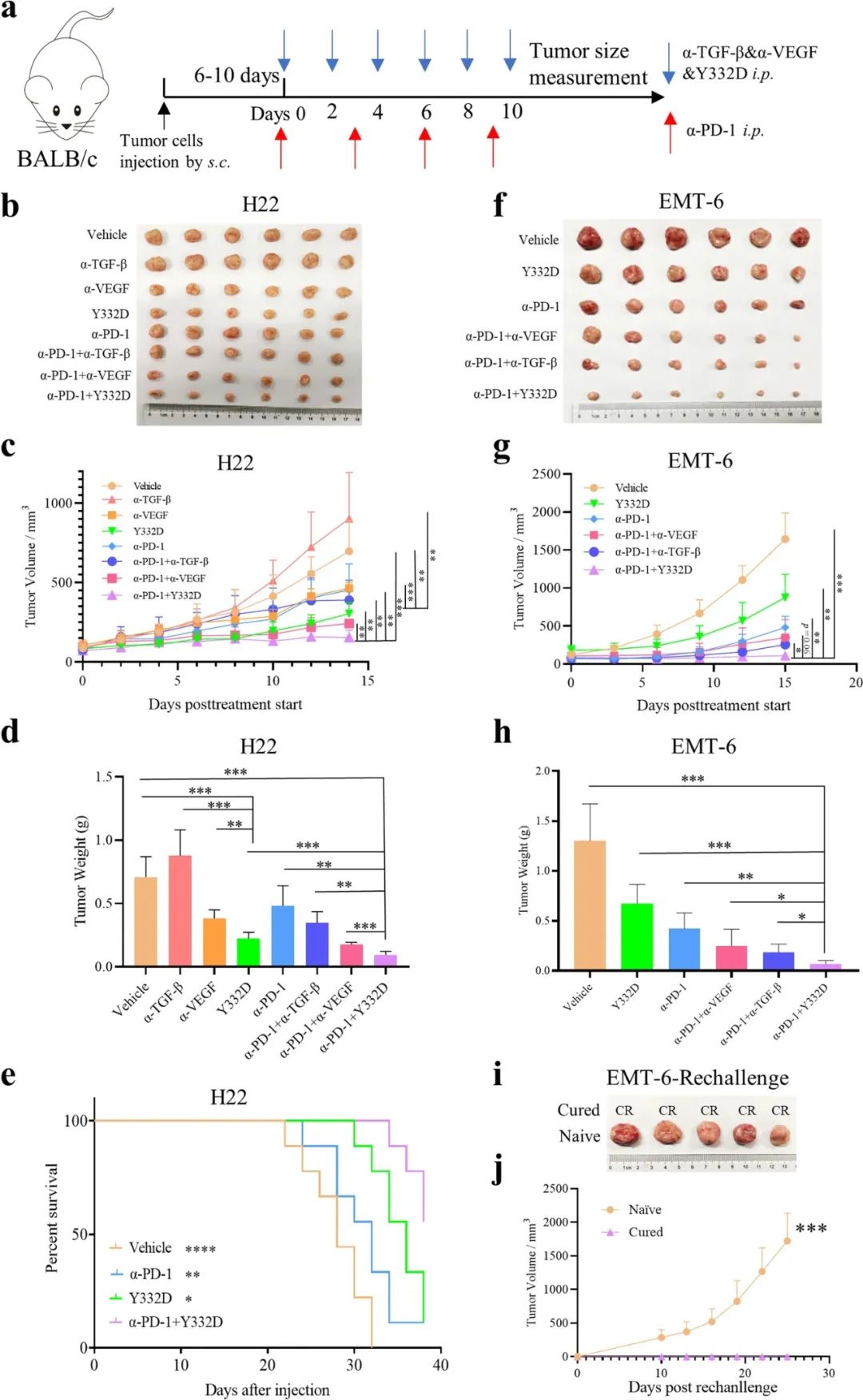
Y332与PD-1抑制剂可实现协同增效
免疫荧光染色和流式细胞术分析显示,Y332与PD-1抑制剂联合治疗有效改善了肿瘤中的淋巴细胞浸润,且浸润的T细胞以CD3+/CD8+细胞毒性T细胞为主,它们可是公认的抗癌主力。
RNA测序还显示,大量浸润的免疫细胞还普遍存在细胞毒性相关基因(如Gzma/Gzmb)和趋化因子相关基因(如CXCL9/11)的表达显著上调;GO富集分析则提示,与抗肿瘤免疫应答高度相关的众多通路也在联合治疗组中显著富集,说明免疫细胞由此战斗力大幅增强,是名副其实的精锐了。
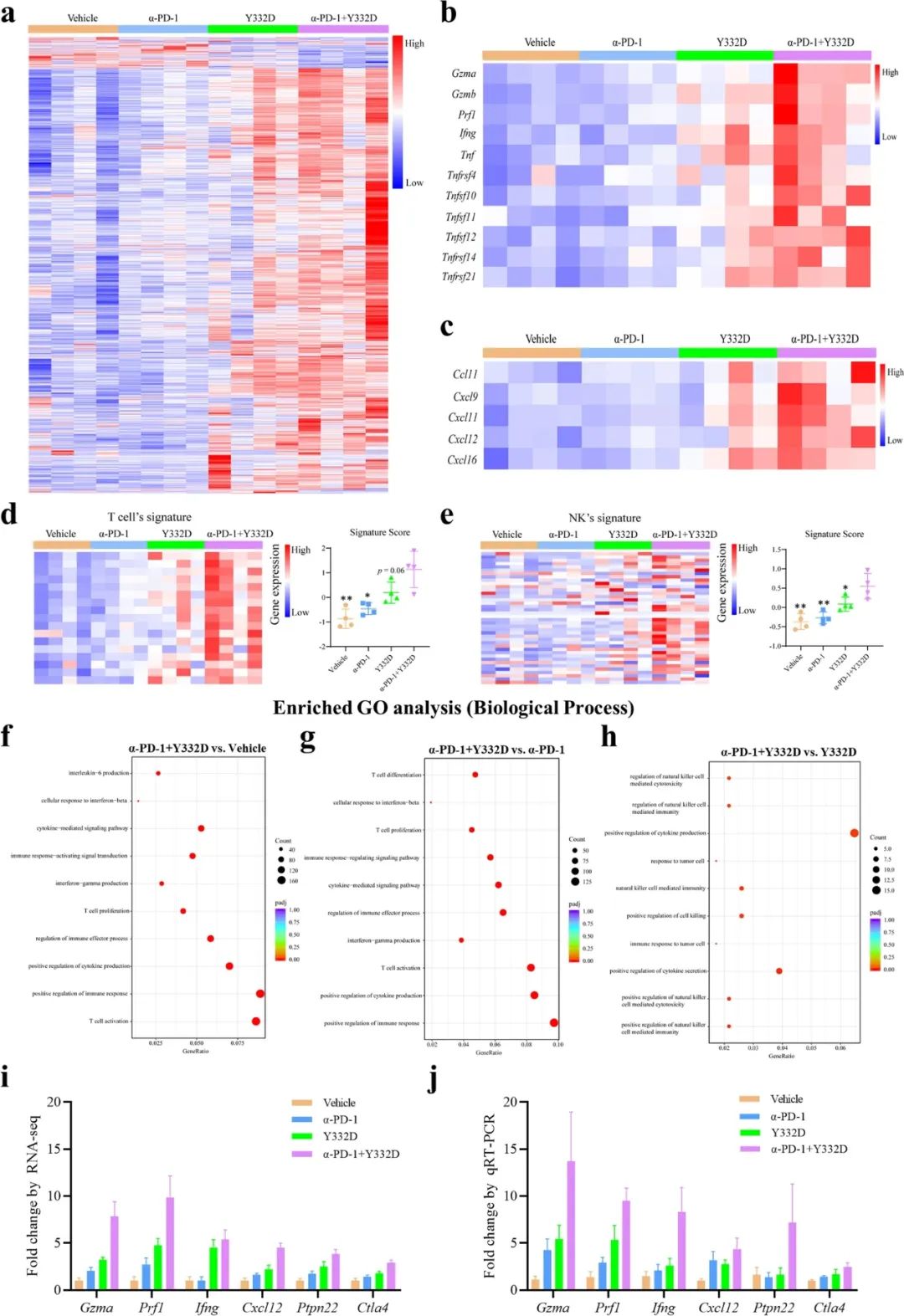
RNA测序热区图和GO富集分析结果
这些分析都能说明,双抗Y332能够有效逆转肿瘤微环境的免疫抑制状态,乃至把肝癌这样“偏冷”的肿瘤变为“热肿瘤”,成为免疫治疗的强力搭档,那就期待它未来在临床研究中的表现吧。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


