研究发现内皮细胞SIRPα信号调控造血祖细胞胸腺归巢和T细胞发育
来源:生物物理研究所 2022-05-13 10:03
CD47-SIRPα阻断是当前肿瘤免疫治疗的研发热点,该研究的新发现对于开展肿瘤免疫治疗的相关研究具有重要提示意义。
近日,eLife发表了中国科学院生物物理研究所朱明昭课题组题为Endothelial SIRPα signaling controls VE-cadherin endocytosis for thymic homing of progenitor cells的研究论文。该研究发现造血祖细胞高表达的CD47配体与胸腺门控内皮细胞上高表达的SIRPα受体相互作用,通过SIRPα下游ITIM-SHP2-Src信号通路,调控VE-cadherin内吞,打开细胞连接,促进造血祖细胞跨内皮迁移,影响T细胞的早期发育。
胸腺是哺乳动物T细胞发育的必要淋巴器官,是建立T细胞适应性免疫应答的基础,在感染、肿瘤、自身免疫等各种病理过程中发挥重要作用。源于骨髓的造血祖细胞经过血液循环迁移归巢到胸腺,是T细胞得以正常发育的前提,对于病理条件下的T细胞免疫重建尤为重要。2016年,朱明昭课题组首次发现鉴定了一群调控造血祖细胞胸腺归巢的关键血管内皮细胞,命名为胸腺门控内皮细胞(Thymic portal endothelial cell,TPEC)(Nat Commun. 2016)。但TPEC调控造血祖细胞胸腺归巢的分子机制尚不清楚。
该研究中,研究者通过RNA-seq转录组数据分析并经过验证发现,SIRPα是TPEC的一个特征分子。SIRPα通常表达在巨噬细胞、树突状细胞等髓系免疫细胞上,在CD47配体分子的作用下,传递“don’t eat me”信号,是固有免疫检验点。SIRPα在基质细胞上的作用尚不清楚。研究者们利用全身性基因敲除小鼠、条件性基因敲除小鼠、骨髓嵌合体、细胞过继转移等多种动物实验模型,证明了内皮细胞表达的SIRPα促进造血祖细胞的胸腺归巢,维持胸腺早期T祖细胞(Early T cell progenitor,ETP)的数量,调控胸腺细胞的发育。
为进一步揭示其分子机制,研究者进行了系列体外实验。研究基于MS1血管内皮细胞系,构建了SIRPα完全缺失、SIRPα胞内段缺失、野生型SIRPα回补,SIRPα胞内段ITIM基序突变回补、SHP2组成性活化回补等多种细胞株,并通过Src激酶抑制剂等手段,结合Transwell 实验、VE-cadherin内吞免疫荧光成像等方法,证明了SIRPα受体通过ITIM-SHP2-Src信号通路促进VE-cadherin的内吞和造血祖细胞(或T淋巴细胞)的跨内皮迁移。此外,研究还发现,造血祖细胞,特别是迁入胸腺的原始ETP,高表达CD47分子;来自于CD47基因敲除小鼠(或经过CD47阻断)的造血祖细胞或T细胞,其跨内皮迁移能力显著降低。与此相一致地,CD47基因敲除小鼠也表现为造血祖细胞胸腺归巢的缺陷。
上述研究较完整地展现了造血祖细胞与胸腺门控内皮细胞通过CD47-SIRPα相互作用,激活胞内ITIM-SHP2-Src信号通路,调控VE-cadherin内吞、造血祖细胞胸腺归巢和T细胞发育的细胞和分子机制及其生物学作用(如图)。为干预调控T细胞发育和免疫重建,理解跨内皮细胞迁移的调控机制提供了新思路。CD47-SIRPα阻断是当前肿瘤免疫治疗的研发热点,该研究的新发现对于开展肿瘤免疫治疗的相关研究具有重要提示意义。
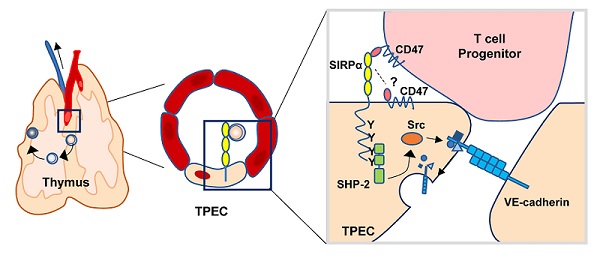
胸腺门控内皮细胞SIRPα信号调控造血祖细胞胸腺归巢和T细胞发育
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


