Science子刊:CAR-T疗法新突破,一招治疗所有血液癌症
来源:生物世界 2023-09-06 11:44
据悉,研究团队正在进行进一步的毒理实验,并在其他模型中进行验证,为进入人体临床试验做准备。
宾夕法尼亚大学佩雷尔曼医学院 Saar Gill 教授、Carl June 教授等在 Science 子刊 Science Translational Medicine 上发表了题为:Epitope base editing CD45 in hematopoietic cells enables universal blood cancer immune therapy 的研究论文。
CD45存在于几乎所有的血液细胞表面(当然也包括血液癌细胞),该研究使用腺嘌呤碱基编辑器(ABE)开发了一种“表位编辑”策略,碱基编辑后CD45能够在血液系统内正常工作,而又不被CAR-T细胞识别。
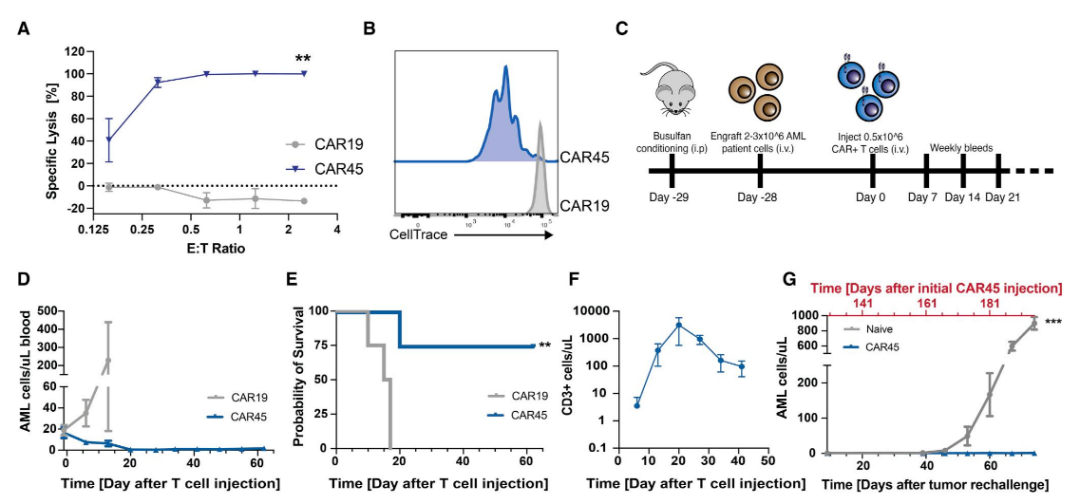
使用这种“表位编辑”策略对造血干细胞和CAR-T细胞进行改造,输入体内后,这些靶向CD45的CAR-T细胞不会自相残杀,也不会杀死输入的表位编辑的造血干细胞,但能够杀死表达正常CD45的血液癌细胞。

论文共同通讯作者、宾夕法尼亚大学细胞免疫疗法中心主任 Carl June 教授表示,目前CAR-T细胞疗法的一个缺点是,每种疗法必须根据不同癌症类型的靶点单独开发。而这项研究为更通用的方法奠定了基础,有望将CAR-T细胞疗法扩展到所有血液类癌症。
CD45存在于几乎所有的血液细胞表面,并且通常在血液肿瘤细胞上高表达。如果直接开发一款靶向CD45的CAR-T细胞疗法,确实可以清除血液肿瘤细胞,但这会清除患者其他健康的血液细胞,包括红细胞、血小板,甚至是产生新的血细胞的骨髓干细胞。此外,T细胞也属于血液细胞,通常也表达CD45,因此,靶向CD45的CAR-T细胞疗法在输入患者体内之前就会发生自相残杀。
为了克服这一挑战,研究团队使用碱基编辑(base editing)技术开发了一种表位编辑新策略,这涉及CAR-T细胞和造血干细胞(HSC)的基因编辑,以改变CAR-T细胞与CD45蛋白结合的“表位”。碱基编辑后的CD45仍然有效,但与正常CD45有很大差异,因此靶向CD45的CAR-T细胞不能识别和攻击它们。
因此,这本质上是造血干细胞移植和CAR-T细胞疗法的结合。当这些编辑后的靶向CD45的CAR-T细胞输入后,能够杀死携带正常CD45的血液癌细胞,包括患者来源的急性髓系白血病、B细胞淋巴瘤和急性T细胞白血病。但它们不会自相残杀,也不会杀死移植的表位编辑的造血干细胞。直接基因敲除CD45的造血干细胞不同的是,表位编辑的造血干细胞能够植入、持续存在和分化,从而产生新的血液细胞。
研究团队在细胞和小鼠模型中进行了大量实验,以测试了这一表位编辑策略的可行性。试验结果显示,这种新方法不仅可以阻止靶向CD45的CAR-T细胞的自相残杀或攻击表位编辑的造血干细胞,而且可以迅速摧毁血液癌细胞。在小鼠实验中,靶向CD45的CAR-T细胞在输入后3周内消除了白血病细胞,并且在两个多月后仍然存在并且能够持续杀死白血病细胞。
据悉,研究团队正在进行进一步的毒理实验,并在其他模型中进行验证,为进入人体临床试验做准备。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


