醛缩酶立体选择性新机制及分子设计方面取得重要进展
来源:网络 2023-05-19 17:57
近日,国际知名期刊《ACS Catalysis》在线发表了生命科学技术学院冯雁团队的研究成果 “Discovery and Engineering of the L‑Threonine A
近日,国际知名期刊《ACS Catalysis》在线发表了生命科学技术学院冯雁团队的研究成果 “Discovery and Engineering of the L‑Threonine Aldolase from Neptunomonas marine for the Efficient Synthesis of β‑Hydroxy-α-amino Acids via C−C Formation”。上海交通大学生命科学技术学院博士生何远志为论文第一作者,生命科学技术学院冯雁教授和系统生物医学研究院达林泰长聘教轨副教授为共同通讯作者。
β-羟基-α-氨基酸是构筑多种高活性天然产物和药物分子的重要手性砌块,在抗菌、抗肿瘤和免疫抑制等方面具有广泛应用,是药物工业合成中的一类重要目标化合物。由于其具有相邻的双手性(Cα和Cβ)中心,因此探索其高效、严格立体选择性的生物合成方法备受关注。L-苏氨酸醛缩酶(L-threonine aldolase, LTA)可催化醛和甘氨酸发生羟醛缩合反应,具有一步催化合成双手性β-羟基-α-氨基酸的潜力。在本研究中,基于海洋微生物基因组和进化关系分析,首先发现了一个来源于海洋嗜油菌Neptunomonas marine的LTA(NmLTA),该酶在催化C–C缩合反应合成抗感染药物甲砜霉素和氟苯尼考的手性中间体L-threo-甲砜基苯丝氨酸中表现出高催化活性(64.9 U/mg)和强非对映体立体选择性(de值 = 89.5%)。
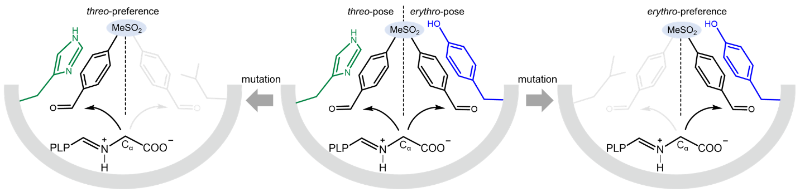
“双构象”非对映体立体选择性调控机制
晶体结构解析发现,底物通道内带正电的氨基酸残基有利于稳定带负电底物;突变和计算机模拟结果表明,活性口袋H140和Y319侧链分别与不同构象底物形成非极性相互作用,形成调控酶非对映体立体选择性的“双构象”作用模式(见图)。为进一步提升该酶的催化性能,采用结构-机制指导的酶底物通道重塑策略,通过定点饱和突变和迭代组合突变,成功获得了催化活性、立体选择性和稳定性等催化功能同时提升的三点突变体N18S/Q39R/Y319L(SRL),在合成手性中间体L-threo-甲砜基苯丝氨酸中表现出严格的非对映体立体选择性(de > 99%)和高时空产率(216 g. L–1 d–1);同时,突变体 SRL可催化不同取代的芳香醛和甘氨酸缩合,合成高光学纯β-羟基-α-氨基酸。
该研究提出了苏氨酸醛缩酶“双构象”非对映体立体选择性调控的新机制,通过重塑底物通道,实现了单一苏式构型产物的高效合成,为催化合成多手性非天然氨基酸的酶分子改造和应用奠定了基础。
冯雁教授团队聚焦分子酶学和合成生物学研究。在科技部合成生物学重点专项、国家自然科学基金等项目的资助下,先后完成了井冈霉烯胺、人参皂苷Rh2和丝氨醇等重大疾病治疗药物中间体的生物合成途径设计及关键酶分子改造等工作,促进了药物合成生物学领域的发展。
本研究得到了科技部重点研发计划(2020YFA0907700)和国家自然科学基金面上项目(32271306 和22177072)的支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


