2021年7月2日Science期刊精华
来源:本站原创 2021-07-08 23:59
2021年7月8日讯/生物谷BIOON/---周又有一期新的Science期刊(2021年7月2日)发布,它有哪些精彩研究呢?让小编一一道来。1. Science:揭示绒毡层siRNA塑造生殖系DNA甲基化机制doi:10.1126/science.abh0556; doi:10.1126/science.abj5020拟南芥雄性生殖系中的基因从头甲基化是由
2021年7月8日讯/生物谷BIOON/---周又有一期新的Science期刊(2021年7月2日)发布,它有哪些精彩研究呢?让小编一一道来。

图片来自Science期刊。
1.Science:揭示绒毡层siRNA塑造生殖系DNA甲基化机制
doi:10.1126/science.abh0556; doi:10.1126/science.abj5020
拟南芥雄性生殖系中的基因从头甲基化是由小RNA引导的DNA甲基化途径(RdDM)催化的。RdDM使用从源基因座(通常是转座子)转录的长24个核苷酸(nt)的小干扰RNA(siRNA)来引导甲基转移酶对同源区域进行甲基化。RdDM在细胞中无处不在,通常对转座子进行甲基化。在一项新的研究中,来自英国约翰内斯中心的研究人员研究了RdDM如何靶向生殖系中的基因,这种重编程如何局限于生殖系,以及如何选择数百个靶基因。相关研究结果发表在2021年7月2日的Science期刊上,论文标题为“Nurse cell-–derived small RNAs define paternal epigenetic inheritance in Arabidopsis”。
这些作者发现,在拟南芥中,数百个基因的生殖系特异性甲基化是由具有不完全序列同源性的高甲基化转座子转录的24nt siRNA建立的。利用CRISPR剔除siRNA源转座子会破坏雄性减数分裂细胞(meiocyte)中相应基因的DNA甲基化,这表明这些siRNA能够通过错配反式靶向甲基化。此外,他们发现减数分裂细胞在24-nt siRNA生物发生过程中是静止的,基因靶向性的siRNA在绒毡层滋养细胞(tapetal nurse cell)中产生并被输送到减数分裂细胞中。绒毡层细胞的siRNA谱与减数分裂细胞的siRNA谱相似,表明在减数分裂早期,大量的siRNA通过连接这些细胞的细胞质通道(称为胞间连丝)移动。尽管基因靶向性的siRNA在绒毛层中的积累水平与减数分裂细胞中的水平相当,但靶基因在绒毛层中没有甲基化,表明减数分裂细胞可以使用不完全匹配的siRNA来靶向DNA甲基化。
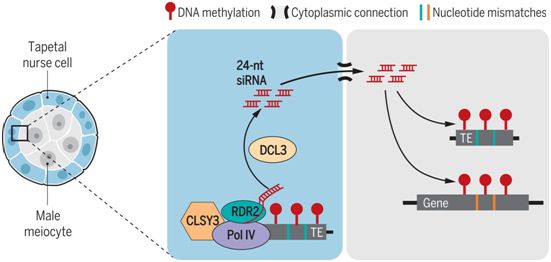
绒毡层siRNA让生殖系DNA甲基化,图片来自Science, 2021, doi:10.1126/science.abh0556。
2.Science:成功构建基于蛋白-蛋白相互作用的切换开关,可在几秒钟之内对输入信号作出反应
doi:10.1126/science.aav0780; doi:10.1126/science.abj5028
合成生物学提供了一种方法来改造细胞以执行新的功能,比如当它们检测到某种化学物时发出荧光。通常情况下,这是通过改变细胞使其表达可被某种输入触发的基因来实现的。然而,由于细胞转录和翻译必要的基因需要时间,在检测分子等事件和由此产生的输出之间往往有很长的滞后期。如今,在一项新的研究中,来自美国麻省理工学院的研究人员开发出一种设计此类合成电路的替代方法,它完全依赖于快速、可逆的蛋白-蛋白相互作用。这意味着不需要等待基因被转录或翻译成蛋白质,因此合成电路可以更快地被打开--在几秒钟之内。相关研究结果发表在2021年7月2日的Science期刊上,论文标题为“An engineered protein-phosphorylation toggle network with implications for endogenous network discovery”。论文通讯作者为麻省理工学院生物工程教授Ron Weiss。
在这项新的研究中,这些作者使用酵母细胞来承载他们的合成电路,并创建了一个由14种蛋白组成的网络,这些蛋白来自包括酵母、细菌、植物和人类在内的物种。他们修改了这些蛋白,使它们能够在网络中相互调节,以产生响应特定事件的信号。
他们的网络是第一个完全由磷酸化/去磷酸化蛋白-蛋白相互作用组成的合成电路,被设计成一种切换开关--一种能够在两个稳定状态之间快速和可逆地切换的电路,使其能够“记住”一个特定的事件,如接触某种化学物。在这种情况下,靶标是山梨醇,即一种在许多水果中发现的糖醇。一旦山梨醇被检测到,细胞就会以定位于细胞核中的荧光蛋白的形式储存关于这次暴露的记忆。这种记忆也会传递给未来的细胞后代。这种电路也可以通过暴露于不同的分子---在这种情况下,一种叫做异戊烯基腺嘌呤(isopentenyl adenine)的化学物---而被重置。
这些电路网络也可以被编程,以响应输入而执行其他功能。为了证明这一点,这些作者还设计了一个电路,它在检测到山梨醇后关闭了细胞的分裂能力。
3.Science:揭示脂肪组织驻留巨噬细胞产生PDGFcc控制体内脂肪储存,有望开发出治疗肥胖的免疫疗法
doi:10.1126/science.abe9383; doi:10.1126/science.abj5072
为了适应热量摄入的日常和季节性变化,后生动物已经进化出专门用于动态储存和释放能量的脂肪组织。这些脂肪组织的能量储存过多或受损,可导致肥胖、脂肪营养不良或恶病质,并损害机体的平衡。脂肪组织由储存脂肪的脂肪细胞、支持性基质细胞和免疫细胞组成。脂肪细胞在胚胎后期和出生后时期动态地积累或释放脂质。基质细胞包括组织巨噬细胞,它们在从果蝇到人类的整个动物王国中与脂肪细胞紧密联系在一起。具有里程碑意义的研究已表明,在肥胖状态下,单核细胞衍生性巨噬细胞通过CCR2(C-C chemokine receptor type 2, C-C趋化因子受体2型)被招募到组织中,并产生细胞因子,如肿瘤坏死因子(TNF),从而导致全身性炎症、异位脂质储存和胰岛素抵抗。然而,CCR2和单核细胞似乎都不能自行调节脂肪含量或脂肪率。最近在几种模型中的观察表明,巨噬细胞也可能控制脂肪,尽管它们的实际功能和潜在的细胞和分子机制仍然知之甚少。
基于此,在一项新的研究中,来自美国和德国的研究人员假设,与脂肪储存细胞相关的驻留巨噬细胞也可能支持它们的功能。他们利用果蝇和小鼠中存在等效细胞类型和直向同源基因,鉴定出一种保守的分子机制,该机制介导了后生动物中巨噬细胞对脂肪和能量储存的控制。相关研究结果发表在2021年7月2日的Science期刊上,论文标题为“Diet-regulated production of PDGFcc by macrophages controls energy storage”。
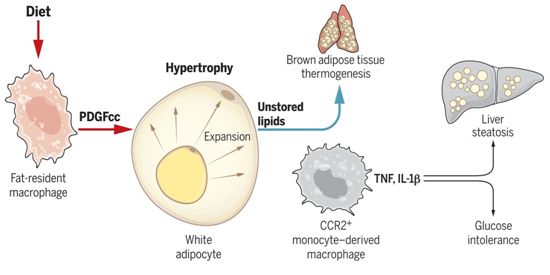
巨噬细胞控制肥胖的示意图,图片来自Science, 2021, doi:10.1126/science.abe9383。
4.Science:星形胶质细胞在感觉和认知能力发展中起着关键作用
doi:10.1126/science.abf5273; doi:10.1126/science.abj6745
长期以来,星形胶质细胞一直被认为只是神经元的支持细胞。近年来,对星形胶质细胞的研究有所增长,逐渐揭示了它们在大脑功能中的重要性。如今,来自法国国家健康与医学研究院(INSERM)、法国国家科学研究中心(CNRS)和法兰西学院生物学跨学科研究中心的研究人员在一项新的研究中,发现它们在出生后大脑可塑性关闭期间的关键作用,发现它们是感觉和认知能力发展的关键。从长远来看,这些发现将使我们有可能设想出在成年人中重新引入大脑可塑性的新策略,从而促进大脑损伤或神经发育障碍后的康复。相关研究结果发表在2021年7月2日的Science期刊上,论文标题为“Astrocytes close the mouse critical period for visual plasticity”。
通过对小鼠视觉皮层的实验,这些作者发现,未成熟星形胶质细胞的存在是大脑可塑性的关键。随后,这些星形胶质细胞在可塑性期间参与发育中的中间神经元的成熟,最终导致可塑性关闭。这一成熟过程是通过一种涉及蛋白质Connexin 30的新机制发生的,这些作者在可塑性关闭期间发现成熟星形胶质细胞中存在高水平的Connexin 30。
这些作者在体外培养了来自年轻小鼠(1至3天大)视觉皮层的未成熟的星形胶质细胞。这些未成熟的星形胶质细胞被移植到成年小鼠的初级视觉皮层中,然后在四天的单眼闭塞(monocular occlusion)后对视觉皮层的活动进行评估,其中单眼闭塞是一种用于评估大脑可塑性的标准技术。他们发现不同于没有接受移植的对照成年小鼠,移植了未成熟星形胶质细胞的成年小鼠呈现出高水平的可塑性。
5.Science:利用sci-Space技术在单细胞水平上揭示细胞基因转录的空间分布模式
doi:10.1126/science.abb9536
一项名为sci-Space的新技术与来自其他技术的数据相结合,可能会在哺乳动物胚胎发育过程中,通过不同细胞的基因表达绘制出四维图谱。这类图谱将描绘出单个细胞中的基因转录本如何反映出时间的流逝、细胞谱系、细胞迁移以及发育中的胚胎位置。它们还将有助于阐明基因表达的空间调节。由美国华盛顿大学医学院、霍华德-休斯医学研究所和布罗特曼-巴蒂精密医学研究所的研究人员领导的一个国际团队在小鼠胚胎中展示了他们的sci-Space技术的概念验证。相关研究结果发表在2021年7月2日的Science期刊上,论文标题为“Embryo-scale, single-cell spatial transcriptomics”。论文通讯作者为华盛顿大学医学院基因组科学教授Jay Shendure、华盛顿大学生物工程系助理教授Kelly R. Stevens、华盛顿大学医学院基因组科学副教授Cole Trapnell。论文第一作者为是华盛顿大学医学院基因组科学系的Sanjay R. Srivatsan和华盛顿大学生物工程系的Mary C. Regier。
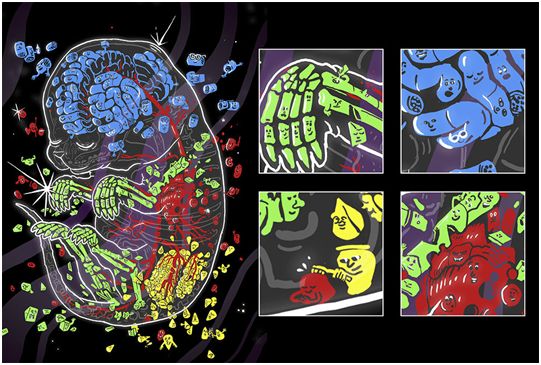
描述了在发育中的小鼠胚胎内,单个细胞聚集在一起形成器官时,sci-Spac技术如何捕捉它们的特性和位置。图片来自Science, 2021, doi:10.1126/science.abb9536。
这些作者早先开发了一种标记细胞核的方法,他们称之为sci-plex技术。然后他们利用一种称为sci-RNA测序的方法,继续对单细胞RNA测序进行索引。如今,通过sci-Space,他们通过分析空间坐标和细胞基因转录本,鉴定出数以千计的基因,这些基因的表达是按照解剖学模式进行的。例如,某些基因图谱出现在大脑和脊髓的神经元中,还有一些出现在心脏的心肌细胞中。他们还使用空间和基因图谱信息来注释细胞的亚型。例如,虽然血管细胞和心肌细胞可能都表达某种特定生长因子的基因,但只有心肌细胞产生某些生长因子受体。
这些作者还观察到,细胞类型在基因表达的空间模式上差异很大。例如,结缔组织祖细胞显示出相对较大比例的空间限制性基因表达。这一观察表明,这些细胞的亚型在整个身体内以位置依赖的方式行事。
为了衡量空间位置对一种细胞类型的基因转录谱的影响,这些作者还计算了细胞之间的物理距离和它们基因表达谱的角度距离。他们指出对于许多细胞类型来说,随着细胞之间物理距离的增加,它们的转录组之间的角度距离也会增加。然而,他们补充说,这种趋势变化很大。它在某些大脑和脊髓细胞中表现得最为明显。其他一些细胞类型的基因转录谱受到它们在发育中的胚胎中的位置的高度影响。其中包括某些软骨细胞,它们成为头部和面部骨骼支架的一部分。
6.Science:科学家识别出与控制机体体重相关的多个基因突变
doi:10.1126/science.abf8683; doi:10.1126/science.abh3556
如今,肥胖在全球范围内造成了大量且不断增长的疾病负担,身体肥胖具有高度的遗传性,对人类遗传学的研究或许能带来生物学和治疗方面的一些见解和启示。近日,一篇发表在国际杂志Science上题为“Sequencing of 640,000 exomes identifies GPR75 variants associated with protection from obesity”的研究报告中,来自美国再生元制药公司等机构的科学家们通过研究分离到了多个在机体体重控制上扮演着关键角色的基因突变,文章中研究人员描述了他们如何分离到这些突变体,并讨论了未来开发治疗肥胖的新型疗法的可能性。
人类基因组大约有30亿个碱基对,此前研究表明,大部分的碱基对在人群之间都是相同的,只有几百万个突变体主要负责引发不同人群之间的差异,在这些突变体中,很多基因突变体都是非编码的,这就意味着其并不携带指令来告诉细胞制造蛋白质。为此研究人员重点对那些能编码蛋白的基因突变体进行研究,即构成外显子组的基因突变体,因为这些突变体是唯一可能能控制机体体重的突变体。为了寻找到外显子组的差异,研究人员对来自美国、英国和墨西哥共计645,626名参与者的组织样本进行遗传学分析,结果发现了16个基因突变体与机体体重维持或控制密切相关。
随后研究人员在小鼠机体中测试了一种基因突变体,并将这些携带突变体的小鼠与不携带突变体的小鼠进行对比,通过给予其喂食相同的高脂肪饮食,研究者发现,携带基因突变体的小鼠往往会获得更多的体重。尽管目前研究人员的研究结果尚处于初步阶段,但相关研究结果暗示了后期他们开发治疗方法的可能性,这些治疗方法或能克服因与体重相关的基因突变体而导致的对蛋白质生产的控制。
7.Science:河流可能不存在失踪的塑料汇
doi:10.1126/science.abe0290
在海洋中观测到大量塑料的情况下,对来自河流的微塑料流量的估计,使得人们认为那里一定存在一个巨大的、身份不明的塑料汇(sink of plastics)。Weiss等人的研究表明,可能根本不存在这样的失踪的塑料汇。通过重新制定如何从粒子数的观察中计算微塑料流量,他们证明这些微塑料流量被高估了两到三个数量级。这就解释了为什么塑料在海洋中的停留时间似乎短得令人费解,并提示着海洋塑料可能比以前认为的要持续和降解更长的时间。
8.Science:解析出乙基辅酶-M还原酶的三维结构
doi:10.1126/science.abg1765
当从海底渗出物中释放出来时,小的碳氢化合物会迅速被微生物消耗掉。甲烷的含量很高,它既可由微生物通过众所周知的生物化学途径产生,也可由微生物消耗。乙烷也是气态碳氢化合物的一个主要天然成分,不太了解的是,它是如何被代谢的。为了了解微生物如何利用这种能量和碳源,Hahn等人解析出一种他们称为乙基辅酶-M还原酶(ethyl coenzyme-M reductase)的酶的X射线晶体结构,其中该酶将乙烷转化为硫醚乙基辅酶M(thioether ethyl-coenzyme M)作为分解代谢的入口。他们发现了一个扩大的活性位点,并利用氙气衍生实验,发现了一条穿过这种蛋白质的独特隧道,该隧道被认为允许气体底物进入。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


