BRAIN:肠菌能够“传播”认知损伤?科学家首次证实,肠菌与阿尔茨海默病的发生之间存在因果关联,或由损害成人海马神经发生介导
来源:奇点糕 2023-10-20 11:28
随着研究的深入,大家越来越认可,阿尔茨海默病(AD)是一种多因素疾病,受到遗传、生活方式和环境因素的多重影响。
随着研究的深入,大家越来越认可,阿尔茨海默病(AD)是一种多因素疾病,受到遗传、生活方式和环境因素的多重影响。
肠脑轴研究已经确认了肠道微生物与AD之间的相关性,使用AD模式小鼠5xFAD的粪菌移植(FMT)研究表明,肠道微生物与AD的一些病理特征有关,如空间记忆和成年后的海马神经发生(AHN)受损[1],但是目前,还没有直接证据证明肠道微生物与AD的因果关系。
在Brain杂志今天刊登的一项研究[2]中,来自爱尔兰科克大学、伦敦国王学院和意大利IRCCS Fatebenefratelli研究中心的国际研究团队将AD患者的粪便菌群移植给年轻成年大鼠后,出现AD核心认知症状以及AHN受损,首次证实了肠道微生物诱导AD发生的因果关系,并且强调了AHN受损在其中发挥关键介导作用。

研究人员在意大利IRCCS Fatebenefratelli研究中心招募了69例AD患者和64例认知功能正常的对照群体,采集了血液和粪便样本。
AD患者血浆中的白介素-1β(IL-1β)、炎症小体标志物NLRP3和巨噬细胞迁移抑制因子(MIF)显著增加,表明了他们全身炎症水平的增加。此外,粪便与肠道炎症有关的钙卫蛋白的水平也显著增加。肠道微生物方面,AD患者与对照群体的的肠道微生物α和β多样性没有显著差异,但是AD患者的丁酸盐产生菌的相对丰度下降,致病共生菌脱硫弧菌属的相对丰度升高,这一点和此前在AD转基因小鼠中的发现相似[3]。
肠道微生物特征与简易精神状态评估(MMSE)评分相关,其中短链脂肪酸产生菌粪球菌属的丰度与MMSE评分为正相关关系,脱硫弧菌属和戴阿利斯特菌属的丰度与MMSE评分为负相关关系。
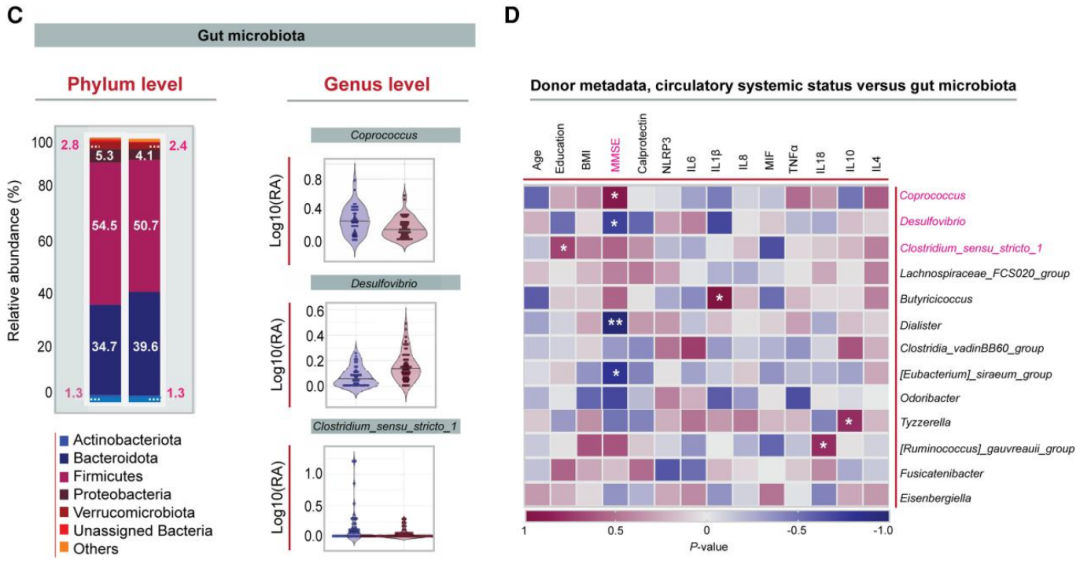
AD患者和对照群体在门和属水平上的肠道微生物差异(C)及不同微生物与MMSE评分的关联(D)
接下来,研究人员分别将AD患者和对照群体的粪菌移植给了肠道微生物耗尽的年轻成年大鼠,平均而言,40%的人类供体的微生物在大鼠体内定植,移植后,大鼠肠道中78个属的细菌发生显著变化。与对照群体FMT大鼠相比, AD患者FMT大鼠的脱硫弧菌属丰度呈现出与人类样本相似的特定差异。
虽然AD患者FMT大鼠没有出现肠道炎症,但粪便含水量增加,结肠长度缩短,结肠近端隐窝增生,隐窝深度增加,结肠和回肠上皮负责分泌黏液的杯状细胞数量减少。
同时,AD患者FMT大鼠在莫里斯水迷宫和新物体识别等多个认知功能测试中表现差劲,与AD相关认知障碍的表现一致,将人类供体的情况与大鼠的AD行为表征相关联,进一步证实了FMT对认知功能产生了影响的假设。
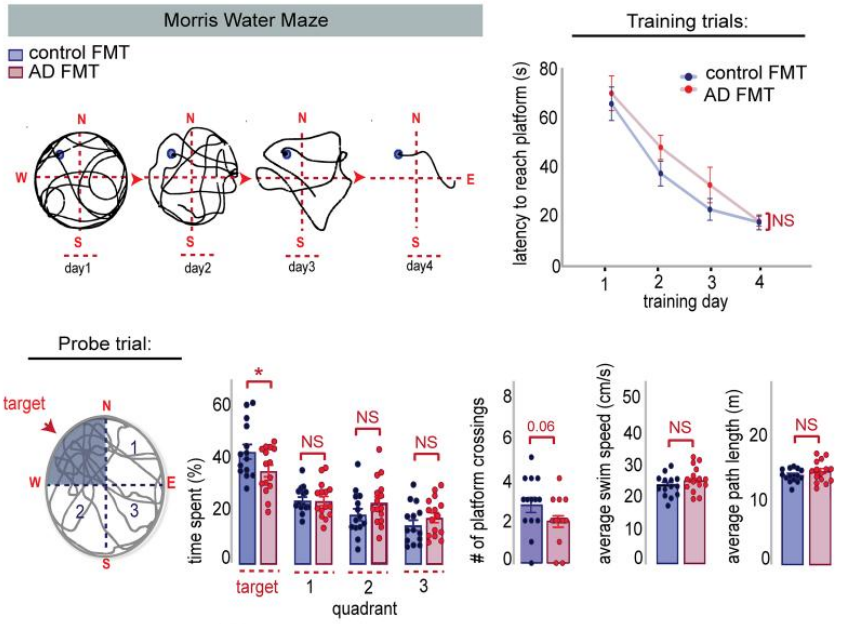
AD患者FMT大鼠(红)和对照群体FMT大鼠(蓝)在莫里斯水迷宫测试中的表现差异
认知功能测试的完成依赖于AHN,这种独特的神经元可塑性形式是认知功能的关键介导因素,AHN受损也是AD发病机制的早期特征,在人类中,早于海马中的神经原纤维缠结和β淀粉样蛋白(Aβ)斑块形成[4,5]。
研究人员确实发现,AD患者FMT大鼠的齿状回中新神经元减少,处于增殖状态的和未成熟的神经元也均减少,与对照群体FMT大鼠相比,神经炎症程度相近,此时两组大鼠大脑的海马和皮层中都还没有出现斑块沉积。这些结果排除了神经炎症的潜在影响,凸显了肠道微生物对AHN的重要影响,并且强调了此前的发现,即认知功能和AHN受损早于Aβ沉积。
由于AHN无法在活人中进行检测,研究人员采取了体外实验的方式,让人胚胎海马祖细胞(HPC)暴露在AD患者和对照群体的血浆中,虽然HPC的平均细胞密度不受影响,但处于增殖状态的比例下降,神经元分化7天后,成熟和未成熟的神经母细胞比例也下降,还表现出明显不同的形态学特征,总神经突长度增加,也就是说,神经元的增殖、分化和形态均受到了影响。
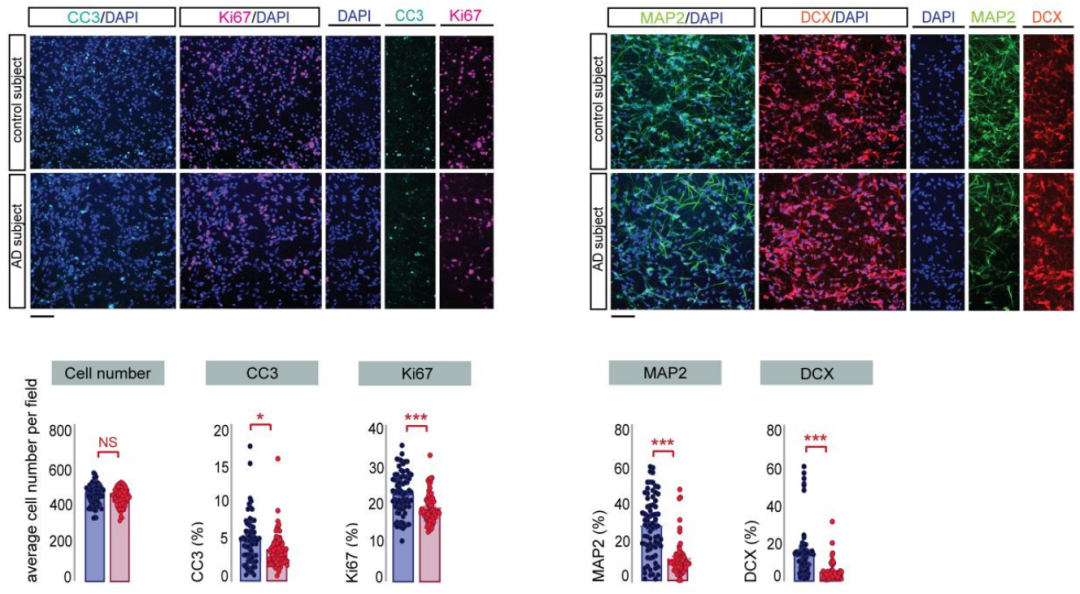
经AD患者(红)和对照群体(蓝)的血浆暴露,增殖状态(Ki67)HPC、成熟(MAP2)和未成熟(DCX)的神经母细胞比例差异
这些特征也和MMSE评分存在关联,增殖、成熟和未成熟的神经元标志物水平与MMSE评分呈正相关关系,脱硫弧菌属和戴阿利斯特菌属的丰度与未成熟神经元标志物水平呈负相关关系。
最后,研究人员对接受FMT的大鼠的盲肠和海马进行了代谢组学分析。毫无疑问,AD患者FMT大鼠和对照群体FMT大鼠的代谢组特征明显分离,涉及到氨基酸组氨酸及其衍生物乙酰组氨酸、氨基己二酸、琥珀酸和色氨酸代谢物犬尿酸等等的变化,这些也都曾在之前的研究中有所体现。
因此,总的来说,这项研究表明,AD相关症状可以通过肠道微生物由AD患者转移到年轻健康的大鼠中,证实了肠道微生物与AD发生的因果关系,使得我们对AD机制的理解向前迈出了重要一步。
由于研究显示,肠道微生物可能是通过损害AHN的方式造成了AD相关认知障碍,早于Aβ等病理特征的发生,因此,这一新发现可能会为在AD早期或前驱时期即进行个性化干预提供可能。
参考文献:
[1] Kim N, Jeon S H, Ju I G, et al. Transplantation of gut microbiota derived from Alzheimer’s disease mouse model impairs memory function and neurogenesis in C57BL/6 mice[J]. Brain, Behavior, and Immunity, 2021, 98: 357-365.
[2] Stefanie Grabrucker, Moira Marizzoni, Edina Silajdžić, et al. Microbiota from Alzheimer’s patients induce deficits in cognition and hippocampal neurogenesis, Brain, 2023, https://doi.org/10.1093/brain/awad303
[3] Chen Y, Fang L, Chen S, et al. Gut microbiome alterations precede cerebral amyloidosis and microglial pathology in a mouse model of Alzheimer’s disease[J]. BioMed research international, 2020, 2020.
[4] Moreno-Jiménez E P, Flor-García M, Terreros-Roncal J, et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer’s disease[J]. Nature medicine, 2019, 25(4): 554-560.
[5] Salta E, Lazarov O, Fitzsimons C P, et al. Adult hippocampal neurogenesis in Alzheimer’s disease: A roadmap to clinical relevance[J]. Cell Stem Cell, 2023, 30(2): 120-136.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


