《分子精神病学》:阿尔茨海默病的血检,男女有别!
来源:奇点糕 2022-08-25 10:00
自古美人迟暮,衰老是每个人都无法逃避的生命历程。
自古美人迟暮,衰老是每个人都无法逃避的生命历程。
面对衰老,我们都希望能够优雅从容地老去。然而,有一种疾病,给本就不美丽的衰老蒙上了一层阴霾,它就是阿尔茨海默病(AD)——痴呆症最主要的类型。
有一些研究发现,与男性相比,女性的大脑和脑脊液中AD病理生物标志物水平较高,与认知能力下降和神经退行性变的相关性更强。血液中的AD生物标志物是否也存在这种相关性,目前仍未可知。
近日,由美国加州大学圣地亚哥分校神经科学系Sarah J. Banks领衔的团队,在《分子精神病学》杂志上发表了一项新的研究成果[1]。
Banks团队发现,虽然男性和女性的血浆p-tau181水平相似,但与男性相比,女性血浆p-tau181水平高与脑葡萄糖代谢较低,脑β-淀粉样蛋白(Aβ)和内嗅皮质tau沉积较多,脑脊液(CSF)p-tau181较高,认知能力下降更快相关。
这个研究结果表明,性别可能会影响血浆p-tau181浓度的临床解释。如果此结果在更大的人群样本中可重复,这项发现对血浆p-tau181作为AD生物标志物和筛选工具,用于预防和治疗性临床试验,将具有重要影响。

论文首页截图
1906年,德国精神学家与病理学家Alois Alzheimer最先发现AD,这是一种发病进程缓慢,随时间不断恶化的神经退行性疾病。当前,AD已经成为一项全球性的医疗健康挑战,仅在美国就有超过九分之一的65岁以上成年人受到影响[2]。
目前,AD的发病原因仍然不明,有几个不同的假说尝试解释AD的病因。占主导的一个病因解释是1991年提出的Aβ假说,认为Aβ在大脑沉积可能是导致AD的根本原因[3]。此外,Tau蛋白假说认为Tau蛋白异常是引起AD病情发展的主因[4]。
虽然Aβ正电子发射断层扫描和脑脊液检测,已大大提高了AD诊断和预后的准确性[5-7],但是这些方法不仅价格昂贵,而且具有侵入性,使其在很大程度上难以在临床上应用。因此,AD患者血液中的生物标志物可能是潜在替代品[8]。
最近的研究表明,血浆p-tau181可以识别出患有AD的人,区分Aβ阳性和Aβ阴性个体,其准确度与已建立的AD生物标志物预测方法相当[9]。此外,通过[18F] Flortaucipir正电子发射断层成像(FTP-PET)显示,基线时较高的血浆p-tau181与较高水平的皮质tau相关[10]。
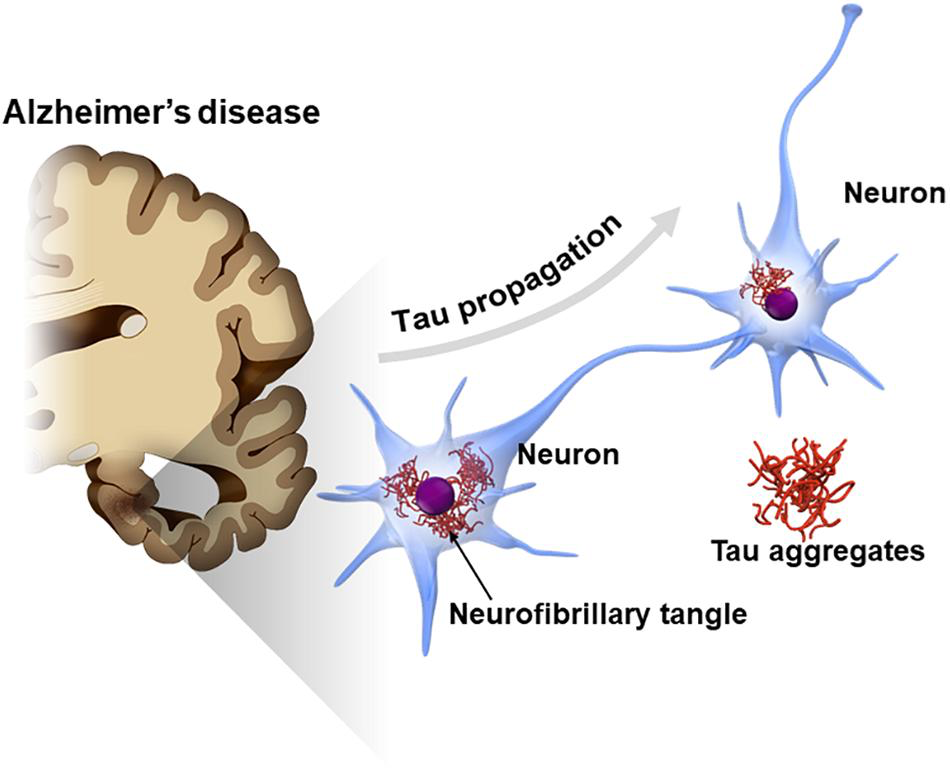
图源[11]
不仅如此,越来越多的证据表明与男性相比,女性AD渐变谱的CSF和脑中tau水平更高[12]。一项尸检研究发现,tau病理每增加1个单位,女性临床患AD的几率就会增加13倍,而男性的几率仅增加1.4倍[13]。
另一项研究表明,与男性相比,在CSF tau水平较高的个体中,女性海马萎缩更明显,执行功能下降更快[14]。结合先前证据表明tau蛋白沉积与AD临床表现之间存在强关联[15],女性tau病理的数量增加和对tau病理易感性增加,可能会导致认知能力下降更急剧[16]。
然而,目前尚不清楚血浆p-tau181中是否存在类似的性别差异,以及它与认知能力下降、AD风险和其他AD生物标志物的关联。
鉴于此,Banks团队尝试回答如下三个问题:①认知和临床渐变谱的个体中血浆p-tau181的横断面和纵向水平是否因性别而异;②性别是否改变血浆p-tau181与CSF p-tau181、Aβ沉积、葡萄糖代谢和大脑中的tau沉积;③性别是否改变基线血浆p-tau181对认知衰退和进展为AD痴呆的影响。
为了回答上述问题,Banks团队使用了AD神经影像学倡议(ADNI)数据库。用于本分析的数据于2021年6月从神经影像实验室(LONI)数据库(ida.loni.usc.edu)获得。
本研究样本纳入1060名参与者,其中有494名女性(46.7%)和566名男性(53.4%)。在所有参与者中,359人(33.9%)认知正常,516人(48.7%)被诊断为轻度认知障碍,185人(17.5%)被诊断为痴呆,560人(52.8%)为Aβ阳性。
这个研究样本主要是白人(92.6%),平均年龄为73.8岁,平均受教育年限为16.2年。与男性相比,样本中的女性更年轻,受教育年限更少,CSF p-tau181和脑葡萄糖代谢水平更高,更可能认知正常,不太可能患轻度认知障碍或痴呆(表 1)。为了解释诊断状态的性别差异,研究者在后续分析中额外调整了诊断的影响。
研究结果显示,在整个队列和任何分层组中,未观察到男性和女性的基线血浆p-tau181水平存在显著差异,且在整个队列和分层组中,血浆p-tau181随时间的变化率没有性别差异。也就是说,两性之间的血浆p-tau181浓度相似。
那在罹患AD过程中,两性究竟存在什么差别呢?
Banks团队发现,虽然两性之间的血浆p-tau181浓度相似,但女性的表型生物标志物谱表现得更糟糕。
与男性相比,女性的表型生物标志物谱与血浆p-tau181浓度升高有关。具体而言,与男性相比,女性血浆p-tau181水平高与更多的皮质Aβ沉积、CSF中更高浓度的p-tau181、更多的内嗅皮层tau沉积和更低的脑葡萄糖代谢相关。
此外,与男性相比,女性的认知能力下降更快,转化为痴呆的风险更大,这与较高的基线血浆p-tau181水平相关。值得注意的是,以上这些性别差异表现在Aβ阳性参与者和轻度认知障碍个体中,而非痴呆症患者中。
Banks团队还发现,与Aβ阳性男性相比,Aβ阳性女性与较高的基线血浆p-tau181相关的痴呆发病率更高。
这一研究结果与既往研究一致。例如,有研究表明,与男性相比,在大脑和CSF中tau负荷升高的情况下,女性表现出更快的认知衰退轨迹和更高的临床AD确诊率[13,14];还有研究表明,尽管女性在早期病理性AD阶段表现出更大的认知复原力,但在更晚期的病理阶段,她们在临床上的衰退速度更快[17]。
因此,本研究中Aβ阳性和轻度认知障碍组中的一些女性,很可能突破了其AD轨迹上的关键点,临床症状开始加速。
总的来说,Banks团队的研究结果表明,性别可能会影响血浆p-tau181浓度的临床解释。虽然男性和女性的血浆p-tau181水平相似,但与男性相比,女性血浆p-tau181水平高与脑葡萄糖代谢较低,Aβ和内嗅皮质tau沉积较多,CSF p-tau181较高,认知能力下降更快相关。
需要指出的是,本研究还有一定的局限性。研究样本主要是非西班牙裔白人参与者,这限制了研究结果的普遍性。之前有研究表明,临床AD轨迹的性别差异,在种族和种族群体之间存在差异[18],未来应该研究性别是否会影响不同人群样本中血浆p-tau181浓度的临床解释。
此外,本研究对内嗅皮层tau沉积是通过PET扫描获得的,但是是在测量血浆p-tau181几年后获得的。尽管研究者针对此时间滞后问题调整了模型,但无法就血浆p-tau181水平与皮质tau沉积之间关系的时间性得出结论。
如果这个研究的结论被进一步证实,那么在未来,也许可以通过检测血浆p-tau181中潜在的性别差异,就可以制定出性别特异性指南,还可以将其用作临床试验中的筛查工具,以及作为预防AD的生物标志物。
参考文献
[1]Tsiknia AA, Edland SD, Sundermann EE, et al. Sex differences in plasma p-tau181 associations with Alzheimer's disease biomarkers, cognitive decline, and clinical progression [published online ahead of print, 2022 Jun 29]. Mol Psychiatry. 2022;10.1038/s41380-022-01675-8. doi:10.1038/s41380-022-01675-8
[2]alzheimers-facts-and-figures.pdf. 2021. https://www.alz.org/media/documents/alzheimers-facts-and-figures.pdf
[3]Hardy J, Allsop D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease. Trends Pharmacol Sci. 1991;12(10):383-388. doi:10.1016/0165-6147(91)90609-v
[4]Mudher A, Lovestone S. Alzheimer's disease-do tauists and baptists finally shake hands?. Trends Neurosci. 2002;25(1):22-26. doi:10.1016/s0166-2236(00)02031-2
[5]Skillbäck T, Farahmand BY, Rosén C, et al. Cerebrospinal fluid tau and amyloid-β1-42 in patients with dementia. Brain. 2015;138(Pt 9):2716-2731. doi:10.1093/brain/awv181
[6]Hansson O, Zetterberg H, Buchhave P, Londos E, Blennow K, Minthon L. Association between CSF biomarkers and incipient Alzheimer's disease in patients with mild cognitive impairment: a follow-up study [published correction appears in Lancet Neurol. 2006 Apr;5(4):293]. Lancet Neurol. 2006;5(3):228-234. doi:10.1016/S1474-4422(06)70355-6
[7]Hanseeuw BJ, Betensky RA, Jacobs HIL, et al. Association of Amyloid and Tau With Cognition in Preclinical Alzheimer Disease: A Longitudinal Study [published correction appears in JAMA Neurol. 2019 Aug 1;76(8):986]. JAMA Neurol. 2019;76(8):915-924. doi:10.1001/jamaneurol.2019.1424
[8]Molinuevo JL, Ayton S, Batrla R, et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 2018;136(6):821-853. doi:10.1007/s00401-018-1932-x
[9]Karikari TK, Benedet AL, Ashton NJ, et al. Diagnostic performance and prediction of clinical progression of plasma phospho-tau181 in the Alzheimer's Disease Neuroimaging Initiative. Mol Psychiatry. 2021;26(2):429-442. doi:10.1038/s41380-020-00923-z
[10]Moscoso A, Grothe MJ, Ashton NJ, et al. Time course of phosphorylated-tau181 in blood across the Alzheimer's disease spectrum [published correction appears in Brain. 2021 Jul 28;144(6):e57]. Brain. 2021;144(1):325-339. doi:10.1093/brain/awaa399
[11]Takeda S. Tau Propagation as a Diagnostic and Therapeutic Target for Dementia: Potentials and Unanswered Questions. Front Neurosci. 2019;13:1274. Published 2019 Dec 13. doi:10.3389/fnins.2019.01274
[12]Shokouhi S, Taylor WD, Albert K, Kang H, Newhouse PA; Alzheimer's Disease Neuroimaging Initiative. In vivo network models identify sex differences in the spread of tau pathology across the brain. Alzheimers Dement (Amst). 2020;12(1):e12016. Published 2020 Apr 9. doi:10.1002/dad2.12016
[13]Barnes LL, Wilson RS, Bienias JL, Schneider JA, Evans DA, Bennett DA. Sex differences in the clinical manifestations of Alzheimer disease pathology. Arch Gen Psychiatry. 2005;62(6):685-691. doi:10.1001/archpsyc.62.6.685
[14]Koran MEI, Wagener M, Hohman TJ; Alzheimer’s Neuroimaging Initiative. Sex differences in the association between AD biomarkers and cognitive decline. Brain Imaging Behav. 2017;11(1):205-213. doi:10.1007/s11682-016-9523-8
[15]Ossenkoppele R, Schonhaut DR, Schöll M, et al. Tau PET patterns mirror clinical and neuroanatomical variability in Alzheimer's disease. Brain. 2016;139(Pt 5):1551-1567. doi:10.1093/brain/aww027
[16]Buckley RF, Scott MR, Jacobs HIL, et al. Sex Mediates Relationships Between Regional Tau Pathology and Cognitive Decline. Ann Neurol. 2020;88(5):921-932. doi:10.1002/ana.25878
[17]Sundermann EE, Biegon A, Rubin LH, et al. Better verbal memory in women than men in MCI despite similar levels of hippocampal atrophy. Neurology. 2016;86(15):1368-1376. doi:10.1212/WNL.0000000000002570
[18]Avila JF, Vonk JMJ, Verney SP, et al. Sex/gender differences in cognitive trajectories vary as a function of race/ethnicity. Alzheimers Dement. 2019;15(12):1516-1523. doi:10.1016/j.jalz.2019.04.006
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


