步履维艰!通用型免疫细胞疗法“大撤退”的背后
来源:奇点糕 2023-07-07 11:57
时至今日,通用型NK细胞疗法在半年前的那场大撤退仍让人心有余悸。
时至今日,通用型NK细胞疗法在半年前的那场大撤退仍让人心有余悸。
先是Fate宣布终止与Janssen的合作,停止4款基于诱导多能干细胞(iPSCs)衍生的通用型NK细胞(iNK)免疫疗法的研发工作,同时宣布裁员60%[1]。随后,几乎在同一时间,Century也宣布取消一款iNK细胞免疫疗法的研发工作,同时裁员25%[2]。
大撤退不是没有原因的。一年前Caribou在欧洲血液学协会大会上发布了通用型CAR-T细胞疗法CB-010的数据:在治疗的6个月后,50%的患者癌症复发了[3]。这个数据让业界对通用型免疫细胞疗法的持久性产生了质疑,Caribou的股价也应声大幅下跌。
不难看出,近年来炙手可热的肿瘤通用型免疫细胞疗法,至少在现阶段还面临很多问题。然而,要理解业界对通用型免疫细胞疗法的热情,以及通用型免疫细胞疗法面临的挑战,我们还得从肿瘤自体细胞免疫疗法说起。
金标准的隐忧
相较于通用型免疫细胞疗法而言,自体型免疫细胞疗法发展更加成熟,目前全球已有9款自体型CAR-T细胞疗法获批上市,其中我国有3款,均为CAR-T,尚无其他类型及来源的免疫细胞疗法获批上市。
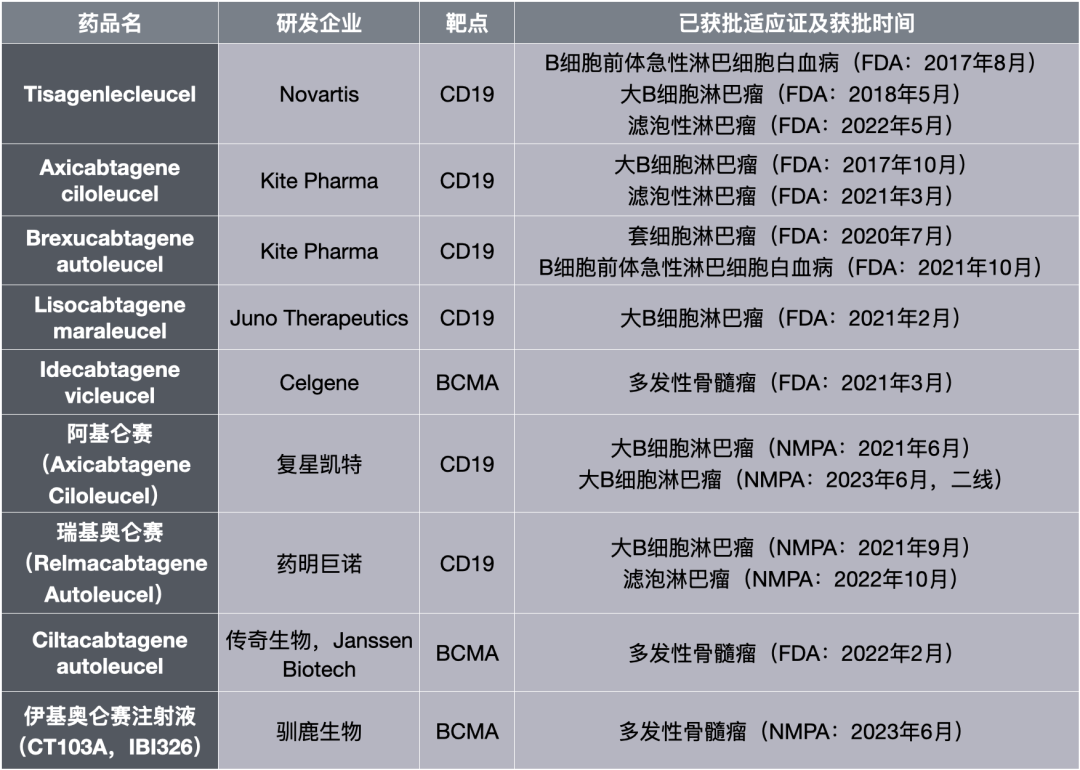
美国FDA和我国NMPA批准的8款自体型CAR-T疗法
顾名思义,自体型CAR-T细胞是从患者体内提取T细胞,经体外改造扩增之后再回输到患者体内。这种疗法对患者的要求较高:首先,癌症患者要能提供充足的健康T细胞;其次,由于CAR-T细胞制作周期比较长,这就要求患者的病情不能进展太快;最后,自体型CAR-T细胞制作成本高昂,绝大部分患者难以承受[4]。
正是基于以上原因,近年来通用型免疫细胞疗法越来越受关注。然而,正如前文提到,现货型细胞免疫治疗所暴露的临床有效性问题是影响技术发展的关键因素。毕竟有效是前提,生产效能提升、成本降低等优势在有效性面前不足为道。
通用型免疫细胞疗法“先天不足”
通用型免疫细胞疗法与自体型细胞免疫疗法最大的不同之处在于,通用型免疫细胞疗法的免疫细胞来自于健康供体或者细胞系,而不是从患者体内提取的。这些同种异体免疫细胞经过一系列的改造之后,成为可以用于多名患者治疗的标准品,而无需针对每名患者进行个性化细胞采集和改造。
至于通用型免疫细胞疗法的细胞来源,有健康供体的外周血单个核细胞(PBMCs)、iPSCs或胚胎干细胞,以及一些特定的细胞系(NK92)等[5]。
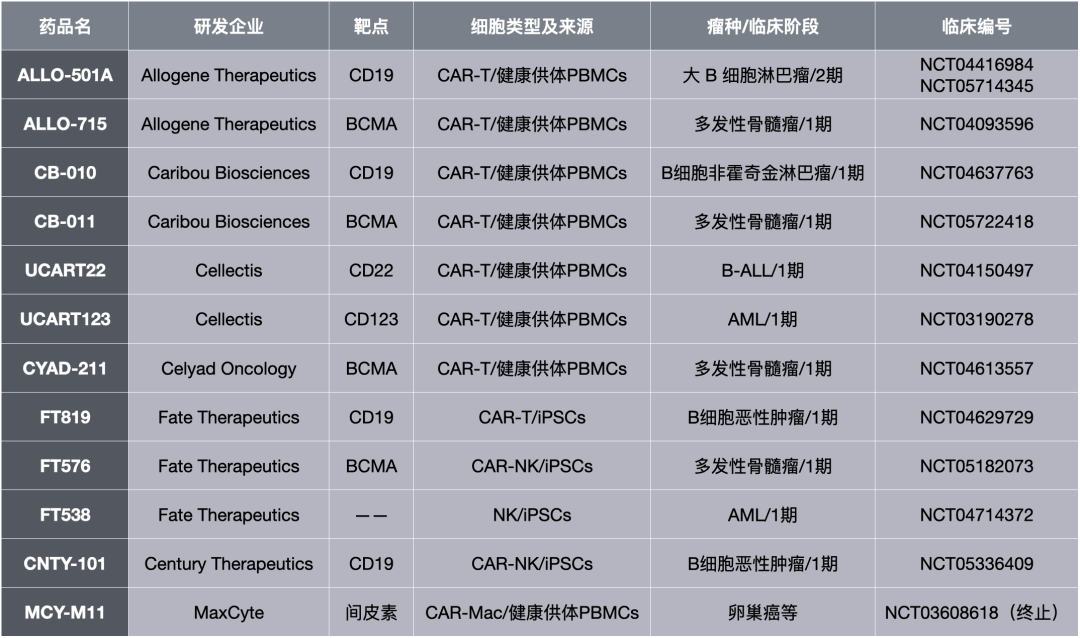
国外进入临床阶段的主要通用型免疫细胞疗法
接下来我们就从三个主要方面阐述通用型免疫细胞疗法面临的问题。
-
移植物抗宿主病(GVHD)
与自体型细胞免疫疗法相比,通用型免疫细胞疗法面临的第一个重要问题是GVHD。
在异体造血细胞移植的过程中,由于供体和受体之间的人类白细胞抗原(HLA)不匹配,会导致供体免疫细胞识别并杀死受体细胞,导致受体的特定组织器官(皮肤、胃肠道和肝脏等)受损,这就是我们常说的GVHD[4]。
一般来说,T细胞是引起急性GVHD的主要免疫细胞。在异体造血细胞移植过程中,GVHD的风险可以通过供体选择,T细胞耗竭或选择,以及使用免疫抑制药物来缓解。但是,由于通用型免疫细胞疗法的抗癌效果需要免疫能力强的细胞,因此上述缓解GVHD的一些策略与通用型免疫细胞疗法的目标相冲突。
对于通用型CAR-T细胞免疫疗法的开发而言,目前常用的降低GVHD的方法是基因编辑。例如Allogene的ALLO-501A就是利用基因编辑技术敲除健康供体来源的T细胞中编码TCR和CD52的基因,以达到降低GVHD风险的目的。不过这种方式也面临一些风险,早在2021年10月,FDA就因一名接受ALLO-501A治疗的患者出现染色体异常(有潜在致癌风险),而叫停了Allogene的所有临床试验[6]。虽然三个月后FDA解除了禁令,但是基因编辑带来的潜在风险仍不可忽视。
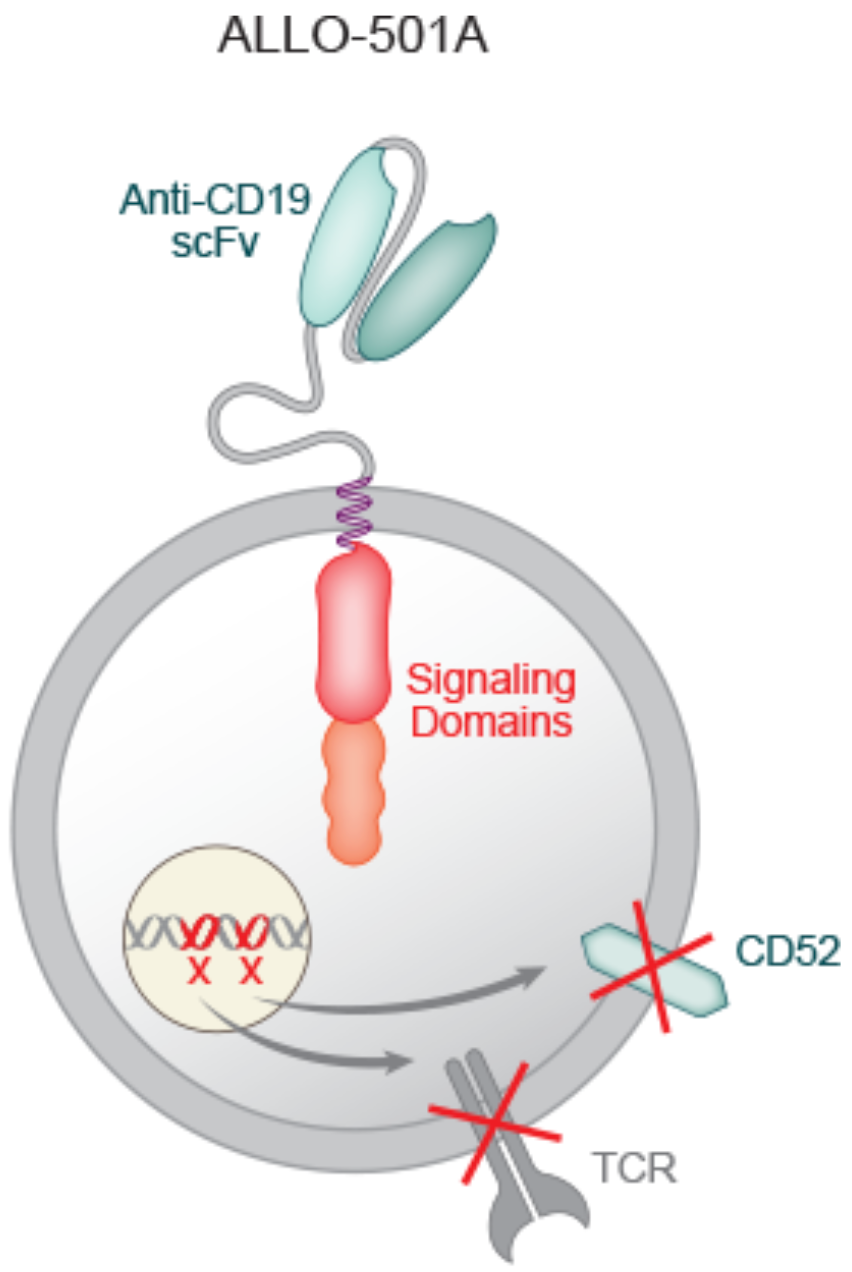
ALLO-501A的设计
-
免疫排斥导致持久性不佳
通用型免疫细胞疗法面临的第二个重要问题是持久性。
已经有临床研究发现,CAR免疫细胞的扩增和持久性对于实现短期和长期疗效都很重要,例如急性白血病的长期缓解与自体型CAR-T细胞的持续时间有关[7]。
事实上,体液循环系统相较于其他器官,在进行异体细胞移植时可能面临更强的免疫排斥[8]。在自体免疫细胞回输的情况下,免疫细胞的寿命会因外来蛋白CARs的免疫排斥而受到影响。
而异体免疫细胞会因CAR和效应细胞都是外来的,进一步增加免疫原性,这可能导致CAR免疫细胞在发挥疗效之前就被排斥掉了。虽然淋巴清除会减轻异体免疫细胞被排斥的风险,但是在免疫重建的时候,这些异体免疫细胞仍有可能会被排斥,进而增加了癌症复发的风险[4]。
此外,对于目前研究热门NK细胞来说,在同种异体NK细胞治疗中,供体NK细胞上表达的抑制性KIR与受体的HLA配体之间的不匹配,会导致免疫排斥的发生,这会限制NK细胞的持久性和临床治疗效果[9-11]。为了避免这种免疫排斥,患者在接受通用型NK细胞治疗之前,需要进行淋巴细胞清除性化疗。
-
治疗效果仍显乏力
通用型免疫细胞疗法面临的最后个重要问题是疗效。从临床数据来看,与金标准自体型细胞疗法相比,通用型早期治疗效果稍逊一筹。
以目前临床进展速度最快的ALLO-501A为例,目前已经发表的1/2期临床数据表明,ALLO-501A治疗复发/难治性大B细胞淋巴瘤的ORR为67%,CR为58%(12名患者的数据)[12];而已经获得FDA批准上市的Axicabtagene ciloleucel的ORR为72%,CR为51%[13],Lisocabtagene maraleucel的这两个数据分别为73%和54%[14];获得NMPA批准的阿基仑赛分别为83%和58%[15],瑞基奥仑赛分别为75.9%和51.7%[16]。因此,通用型CAR-T细胞疗法还需要更大的研究证明其疗效。
从iPSCs衍生的通用型CAR-NK细胞疗法FT576的1期临床的早期数据来看,在9名可评估疗效的多发性骨髓瘤患者中,只有2名患者达到了客观缓解(ORR为22.2%)[17]。而获得FDA批准的Lisocabtagene maraleucel(BREYANZI)和Ciltacabtagene autoleucel(CARVYKTI)的ORR分别为72%[18]和97.9%[19]。不难看出,iPSCs衍生的通用型CAR-NK细胞疗法还有很长的路要走。
实际上,除了上述问题之外,通用型免疫细胞疗法还面临一些其他的问题,此处我们就不再一一列举。
结语
总的来说,自2017年获批上市以来,以CAR-T细胞疗法为代表的自体型免疫细胞疗法改写了血液和淋巴瘤的治疗范式,让很多无药可医的患者实现了长期生存,甚至是临床治愈,它已经成为细胞免疫疗法的金标准。相对更年轻的通用型免疫细胞疗法还需要更多的时间来证明疗效和安全性不逊于甚至是优于现有的自体型细胞疗法,以及治疗成本远低于自体型细胞疗法。
值得关注的是,据国外知名医药媒体FiercePharma报道,美国三家顶级癌症研究机构(纪念斯隆-凯特琳癌症中心、莫菲特癌症中心和希望之城)的细胞治疗负责人,在去年的美国血液学会年会上指出了免疫细胞疗法仍面临的一些问题,例如,企业生产能力不足、生产流程复杂、产品质量堪忧、患者等待时间过长等[20]。
因此,不论是自体还是异体免疫细胞疗法,除了攻克技术路线上的问题,还需要解决细胞生产方面的瓶颈问题,只有这样才能更好地服务于临床,帮助更多患者解除病痛,而这无疑还需要自动化细胞生产与质量控制等技术的交叉和融合。
无论如何,希望细胞免疫疗法能蓬勃发展,让人类在面对癌症时多一种能战胜对方的武器。
参考文献:
[1].https://ir.fatetherapeutics.com/news-releases/news-release-details/fate-therapeutics-announces-termination-collaboration-agreement
[2].https://investors.centurytx.com/news-releases/news-release-details/century-therapeutics-announces-internal-portfolio-prioritization
[3].https://investor.cariboubio.com/news-releases/news-release-details/caribou-biosciences-reports-positive-additional-data-cb-010
[4].Caldwell KJ, Gottschalk S, Talleur AC. Allogeneic CAR Cell Therapy-More Than a Pipe Dream. Front Immunol. 2021;11:618427. doi:10.3389/fimmu.2020.618427
[5].Depil S, Duchateau P, Grupp SA, Mufti G, Poirot L. 'Off-the-shelf' allogeneic CAR T cells: development and challenges. Nat Rev Drug Discov. 2020;19(3):185-199. doi:10.1038/s41573-019-0051-2
[6].https://ir.allogene.com/news-releases/news-release-details/allogene-therapeutics-reports-fda-clinical-hold-allocar-t-trials
[7].Finney OC, Brakke HM, Rawlings-Rhea S, et al. CD19 CAR T cell product and disease attributes predict leukemia remission durability. J Clin Invest. 2019;129(5):2123-2132. doi:10.1172/JCI125423
[8].Forrester JV, Xu H, Lambe T, Cornall R. Immune privilege or privileged immunity?. Mucosal Immunol. 2008;1(5):372-381. doi:10.1038/mi.2008.27
[9].Du N, Guo F, Wang Y, Cui J. NK Cell Therapy: A Rising Star in Cancer Treatment. Cancers (Basel). 2021;13(16):4129. Published 2021 Aug 17. doi:10.3390/cancers13164129
[10].Shimasaki N, Jain A, Campana D. NK cells for cancer immunotherapy. Nat Rev Drug Discov. 2020;19(3):200-218. doi:10.1038/s41573-019-0052-1
[11].Berrien-Elliott MM, Jacobs MT, Fehniger TA. Allogeneic natural killer cell therapy. Blood. 2023;141(8):856-868. doi:10.1182/blood.2022016200
[12].https://ir.allogene.com/news-releases/news-release-details/allogene-therapeutics-provides-additional-allo-501501a-phase-1
[13].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-axicabtagene-ciloleucel-large-b-cell-lymphoma
[14].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lisocabtagene-maraleucel-relapsed-or-refractory-large-b-cell-lymphoma
[15].https://www.fosunkitebio.com/news/details-5082.html
[16].https://www.jwtherapeutics.com/cn/media/press-release/jw-therapeutics-announces-nmpa-approval-of-relmacabtagene-autoleucel-injection-in-china/
[17].Dhakal B, Berdeja J G, Gregory T, et al. Interim Phase I Clinical Data of FT576 As Monotherapy and in Combination with Daratumumab in Subjects with Relapsed/Refractory Multiple Myeloma[J]. Blood, 2022, 140(Supplement 1): 4586-4587.
[18].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-idecabtagene-vicleucel-multiple-myeloma
[19].https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ciltacabtagene-autoleucel-relapsed-or-refractory-multiple-myeloma
[20].https://www.fiercepharma.com/pharma/johnson-johnson-bristol-myers-kite-pharma-car-t-cell-therapy-struggle-sloan-kettering
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


