Nature子刊:从结构上揭示β2肾上腺素能受体的作用机制
来源:生物谷原创 2024-06-24 18:12
在这项新的研究中,莱比锡大学医学物理与生物物理研究所的Peter Hildebrand教授和他的团队展示了通过一种称为β2肾上腺素能受体的肾上腺素结合受体的信号传输是如何在原子水平上进行的。
G 蛋白偶联受体(GPCR)遍布人体各处,参与了许多复杂的信号传导途径。尽管GPCR在许多生物过程中起着重要作用,但它的G蛋白偶联机制和相关的信号传导机制至今仍不为人所知。
在一项新的研究中,来自莱比锡大学的研究人员成功地在原子水平上理解了通过一种肾上腺素结合受体(adrenaline-binding receptor)传递信号的机制。未来,在开发药物时,人们或许可以利用这些成果更好地避免副作用。相关研究结果于2024年6月12日在线发表在Nature Structural & Molecular Biology期刊上,论文标题为“Mechanistic insights into G-protein coupling with an agonist-bound G-protein-coupled receptor”。

每种生物都会对环境做出反应。外界刺激会导致身体释放肾上腺素等信使分子,这些信使分子会与受体结合。结合后的受体将信号传递给其他蛋白。这将触发生化级联反应,导致生物体内的反应,例如肾上腺素结合受体产生的“逃跑或战斗”反应。
药物通常以这些信使分子为模型,通过与受体相互作用发挥作用。如果药物与错误的受体结合或没有将信号传递给正确的细胞内蛋白,就会产生副作用。为了防止这种情况发生,科学家们正在研究受体的工作原理。
在这项新的研究中,莱比锡大学医学物理与生物物理研究所的Peter Hildebrand教授和他的团队展示了通过一种称为β2肾上腺素能受体(β2 adrenergic receptor, β2AR)的肾上腺素结合受体的信号传输是如何在原子水平上进行的。β2AR是一种 G 蛋白偶联受体(GPCR)。GPCR蛋白超家族的成员嵌在细胞膜上。
这些作者利用计算机辅助分子动力学模拟以及生化和功能突变分析进行研究。这样,他们就能观察到β2AR是如何起作用的:通过结合,β2AR改变了细胞内 G 蛋白的三维结构,然后释放出调节分子 GDP。下一步,这种 G 蛋白可通过结合其实际底物 GTP 被激活,并触发细胞内的生化级联反应。他们还发现,β2AR的确切功能取决于多种柔性结构元件的排列。经典的结构生物学方法无法对它们进行表征。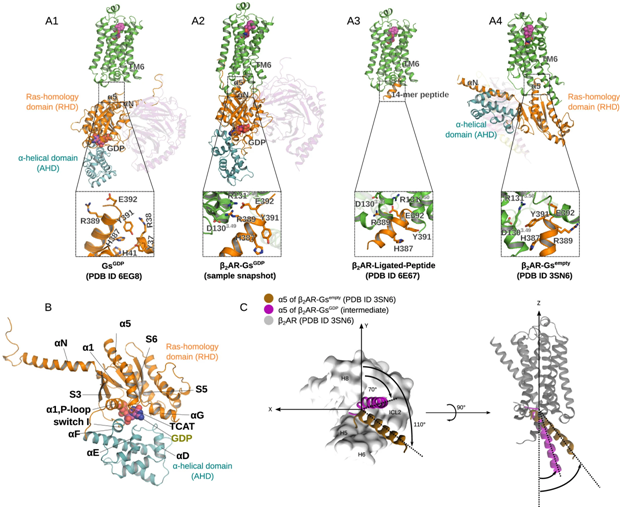
图片来自Nature Structural & Molecular Biology, 2024, doi:10.1038/s41594-024-01334-2
Hildebrand教授目前正计划将计算机辅助生物物理方法应用于其他受体系统,例如莱比锡大学医学研究的重点:肥胖症研究。Hildebrand教授解释说,“当使用具有不同特征的药物时,动态信号传导的比较研究令人兴奋。”
Hildebrand 教授自 2017 年以来一直在莱比锡大学医学院研究受体。2008-2014 年间,他与Klaus-Peter Hofmann教授和Patrick Scheerer博士一起在柏林夏里特医学院研究光感受器视紫红质(rhodopsin)的结构。
如今,他还与诺贝尔奖获得者Brian Kobilka教授和美国斯坦福大学低温电镜学家Yiorgo Skiniotis教授合作,以更好地理解GPCR介导的信号传导。近期,他们共同阐明了 GTP 与 G 蛋白结合及其激活的机制,并将他们的成果发表在Nature期刊上(Nature, 2024, doi:10.1038/s41586-024-07153-1)。
Hildebrand说,“我们如今首次全面了解了受体介导的信号从细胞外部传导到细胞内部的结构机制。除了我的合作者之外,我的成功首先要归功于我团队中才华横溢的年轻科学家Hossein Batebi博士和Guillermo Pérez-Hernández博士。”(生物谷Bioon.com)
参考资料:
Hossein Batebi et al. Mechanistic insights into G-protein coupling with an agonist-bound G-protein-coupled receptor. Nature Structural & Molecular Biology, 2024, doi:10.1038/s41594-024-01334-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


