研究发现组氨酸调控蛋白多肽淀粉样组装并赋予其纳米酶活性
来源:生物物理所 2023-09-25 11:19
生物大分子自组装成超分子结构后会产生重要功能,这与生命系统中的生理或病理状态相关。蛋白质和多肽组装成淀粉样纤维的行为已被认为与神经退行性疾病密切联系。淀粉样蛋白组装体具有相似的交叉β结构,其
生物大分子自组装成超分子结构后会产生重要功能,这与生命系统中的生理或病理状态相关。蛋白质和多肽组装成淀粉样纤维的行为已被认为与神经退行性疾病密切联系。淀粉样蛋白组装体具有相似的交叉β结构,其中β链片段垂直于长纤维排列。这种类型的组装是由主链氢键和侧链相互作用(如π-π堆积、疏水相互作用和范德华)驱动。β-淀粉样蛋白(Aβ)可以交叉β模式自组装成低聚物或纤维丝,损伤神经元和突触,导致神经退行性疾病,如老年痴呆(AD)和帕金森病(PD)。与毒性较小的Aβ1-40相比,Aβ1-42更疏水,更易聚集,被认为是AD发展的更重要因素。然而,Aβ1-42淀粉样蛋白组装在AD发病机制中的基本作用和重要意义尚未完全阐明。对Aβ1-42组装的研究,有助于我们理解AD的发病机制,为诊断和干预提供潜在的靶点。例如,Aβ1-42可以通过和铜等金属离子共聚集,产生reactive oxygen species(ROS),在AD中造成氧化应激。因此,靶向Aβ1-42的自组装过程是颇有前景的治疗策略。
Aβ1-42的19、20号位氨基酸FF作为其组装核心基序,被广泛研究并被报道可形成β结构的超分子纳米结构,因而备受关注。研究FF的自组装行为可以更好地剖析Aβ1-42的聚集发生过程。而FF与Aβ1-42的组装行为不完全相同,这是由于Aβ1-42中的其他氨基酸会影响自组装。氨基酸残基如芳香基、氨基或羧基,可以通过π-π堆积力和其他相互作用(如氢键和范德华力)驱动并影响FF的组装。在20种天然氨基酸中,组氨酸(His)在蛋白质的相互作用中发挥多种作用,并可作为参与酶催化的关键残基。His作为中性形式的芳香π(His)或质子化形式的阳离子(His+),可以与其他芳香氨基酸进行π-π堆叠及H-π作用。His还可以与金属配合调节酶的催化作用。例如,His170与血红素中心的铁配位,以调节辣根过氧化物酶的催化作用。His可以用作修饰或自组装成人工酶的关键单元,以模拟过氧化物酶(POD)样或过氧化氢酶(CAT)样活性。因此,His可调节FF自组装的纳米结构,并可赋予组装体特定的生物活性。Aβ1-42的6、13、14号位均为His,为其和19、20FF的相互作用提供了可能。同时,FF和His的相互作用可能会构成酶的催化活性位点,使得Aβ1-42具有纳米酶的活性从而造成氧化损伤。
本研究表明,His在Fmoc-F-F二肽的组装中具有关键作用,并调控其催化行为,从而为Aβ1-42催化和AD发病机制之间提供了联系。与多数FF组装是在有机溶剂【如二甲基亚砜(DMSO)、六氟异丙醇(HFIP)】中进行的研究不同,该工作证明了氨基酸特别是His水溶液的存在下,可将Fmoc-F-F从纳米棒转变成纤维丝(图1)。
进一步,Fmoc-F-F(His)纤维丝表现出过氧化物酶(POD)活性,表明His对催化做出了重要贡献。研究发现,Aβ1-42纤维丝表现出POD活性(图2a),其中His可能在催化中发挥作用,这是由于Aβ1-42(6His→Ala)POD活性比Aβ1-42低(图2b)。Alphafold2预测结果表明,His/FF的活性位点可能来源于分子间的组装,这说明Aβ1-42纤维丝可以具有多个活性位点。这种特征不同于通常在蛋白质结构内具有单一活性中心的传统酶。此外,组装的Aβ1-42纤维丝很难被降解,且可长期稳定存在,因而易获得持久的催化活性。与传统的天然酶不同,Aβ1-42纤维丝或是一种天然纳米酶,提供了另一种基于多肽组装的催化模式。
研究推测,Aβ1-42纤维丝可以作为具有POD活性的天然纳米酶,在AD发病机制中或存在一定作用(图3)。His残基有可能作为控制AD中Aβ1-42沉积和降低神经毒性的靶点。除了AD中的Aβ1-42纤维丝外,研究在许多疾病中发现了大量淀粉样蛋白聚集体,如II型糖尿病中的胰岛淀粉样多肽、甲状腺癌中的人降钙素、帕金森病中的α-突触核蛋白、肌萎缩侧索硬化症(ALS)中的抗氧化酶SOD1。这些蛋白聚集体可能具有类酶活性,从而通过催化在疾病的发生发展中起到重要作用。该研究为天然纳米酶的发现提供了新见解,以帮助科学家发现蛋白质聚集体在相关疾病中的作用。
相关研究成果以Histidine modulates amyloid-like assembly of peptide nanomaterials and confers enzyme-like activity为题,在线发表在《自然-通讯》(Nature Communications)上。该研究由中国科学院生物物理研究所和吉林大学合作完成。研究工作得到国家重点研发计划、国家自然科学基金创新研究群体项目和重点项目等的支持。
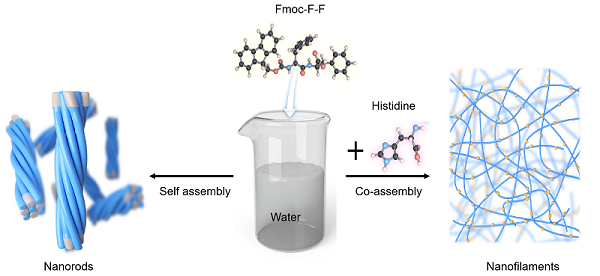
图1. His调控Fmoc-F-F二肽组装示意图

图2. Aβ1-42催化活性。a、Aβ的POD活性;b、Aβ1-42突变体的POD活性。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


