CAR-T细胞疗法研究进展(第44期)
来源:生物谷原创 2024-06-28 10:37
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.Nat Med:靶向PSCA的CAR-T细胞有望治疗转移性去势抵抗性前列腺癌
doi:10.1038/s41591-024-02979-8
用免疫疗法治疗前列腺癌目前还很困难。不过,来自希望之城的研究人员开发的嵌合抗原受体(CAR)T细胞(CAR-T)疗法的首次人体I期试验结果表明,晚期前列腺癌患者可以安全地接受这种细胞免疫疗法的治疗,并具有良好的治疗活性。相关研究结果发表在2024年6月的Nature Medicine期刊上,论文标题为“PSCA-CAR T cell therapy in metastatic castration-resistant prostate cancer: a phase 1 trial”。
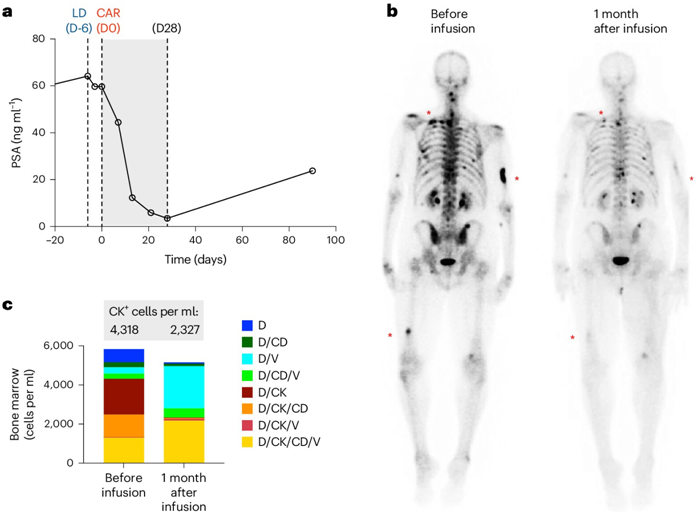
图片来自Nature Medicine, 2024, doi:10.1038/s41591-024-02979-8
这项临床试验使用CAR-T细胞疗法治疗了14名前列腺干细胞抗原(prostate stem cell antigen, PSCA)阳性的转移性去势抵抗性前列腺癌(metastatic castration resistant prostate cancer, mCRPC)患者,这些患者的癌细胞已扩散到前列腺以外,对激素治疗不再有反应。美国每年有 34000 多名患有这种类型前列腺癌的男性患者死亡。
论文共同通讯作者、希望之城血液学与造血细胞移植系副教授Saul Priceman博士和他的团队开发出了靶向前列腺癌中高表达的PSCA的CAR-T细胞。这种疗法从血液中提取患者的免疫细胞(即T细胞),并在实验室中用CAR对提取出的T细胞进行重编程,使之能够识别并攻击癌细胞表面上的PSCA蛋白。将这些经过重编程的 CAR-T 细胞输注回患者体内,消灭癌细胞。
论文共同通讯作者兼论文第一作者、希望之城肿瘤内科与治疗研究系教授Tanya Dorff博士说,“前列腺癌被称为免疫沙漠——这种癌症的肿瘤微环境很难通过免疫疗法来治疗,因为肿瘤内没有大量的T细胞。需要一些非常强大的东西来克服这一点。我们的研究表明,希望之城针对前列腺癌的CAR - T细胞疗法可能离这一目标更近了一步。”
2.Cancer Discov:CD28共刺激可提高CAR-NK细胞的持久性和抗肿瘤活性
doi:10.1158/2159-8290.CD-24-0096
在一项新的研究中,来自德克萨斯大学MD安德森癌症中心的研究人员发现,在表达靶向CD70+癌症的脐带血衍生嵌合抗原受体(CAR)的自然杀伤细胞(CAR-NK)中加入CD28共刺激,能显著增强CAR-NK细胞的抗肿瘤疗效和长期细胞毒性。这表明在血癌和实体瘤的临床前模型中,添加CD28(成熟NK细胞中通常不存在的主要存在于T细胞中的共刺激分子)可以增强CAR-NK的功能,这表明未来的NK细胞疗法应该考虑采用这种基因改造方法。相关研究结果于2024年6月20日在线发表在Cancer Discovery期刊上,论文标题为“CD28 costimulation augments CAR signaling in NK cells via the LCK/CD3Z/ZAP70 signaling axis”。
论文通讯作者、德克萨斯大学MD安德森癌症中心干细胞移植与细胞疗法教授Katayoun Rezvani博士说,“基于NK细胞治疗癌症的先天抗肿瘤活性以及CD70作为靶抗原的潜力,CD70靶向CAR-NK细胞有望成为许多实体瘤的有效治疗手段。在探索了多种共刺激分子后,我们发现添加 CD28 是提高CAR-NK细胞持久性和疗效的一种值得采用的方法,这表明有可能取得很好的疗效。”
CD70表达已被证实有助于肿瘤进展和免疫逃避,使其成为CAR-NK细胞疗法的理想靶点。因此,Rezvani实验室首席研究科学家 Sunil Acharya 博士等人试图改造和优化 CD70 靶向 CAR-NK细胞,将其用作癌症细胞疗法。为了实现这一点,他们在 CAR-NK 细胞中整合了 CD70 的天然受体 CD27,以结合 CD70+癌细胞。他们还评估了与CD3ζ配对的多种共刺激分子,包括CD28,以增强CAR-NK细胞的活性。最后,根据先前的研究结果,这些CAR-NK细胞还包括IL-15以提高NK细胞的持久性,以及作为安全开关的iC9。
含 CD28 的 CD70靶向CAR-NK 细胞在体外和多种血液肿瘤和实体瘤模型中对 CD70+ 肿瘤细胞表现出了很高的细胞毒性。CD28 始终是所测试的顶级共刺激调控分子之一。经过仔细研究,这些作者发现 CD28 激活了CAR-NK 细胞中涉及 LCK、CD3ζ 和 ZAP70 的关键信号通路,从而增强了它们的抗肿瘤活性。
3.hLife:我国科学家发现 BCMA-CD19 双特异性 CAR-T 细胞有望用于治疗慢性炎性脱髓鞘性多神经病变
doi:10.1016/j.hlife.2024.05.005
慢性炎性脱髓鞘性多神经病变(chronic inflammatory demyelinating polyneuropathy, CIDP)是一种不常见的疾病,具有突发性症状,包括影响运动、感觉、语言、呼吸和心率的神经损伤。超过 80% 的患者会出现肌肉无力、步态受损、腱反射消失、感觉丧失、平衡问题,严重者还会出现瘫痪、心律不齐和呼吸困难。目前,糖皮质激素、血浆置换和静脉注射丙种球蛋白(IVIg)等治疗方法可以帮助控制症状,但无法彻底根除这种疾病。
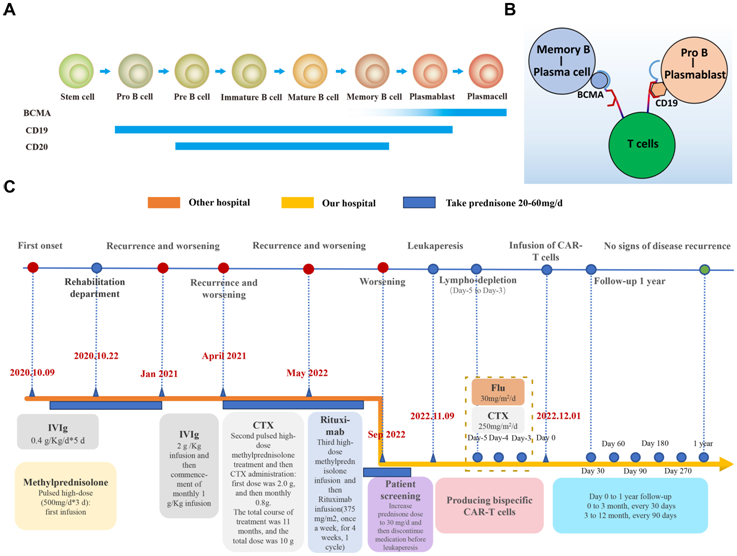
图片来自hLife, 2024, doi:10.1016/j.hlife.2024.05.005
在一项新的研究中,来自中国徐州医科大学的研究人员揭示了BCMA-CD19双特异性CAR-T细胞治疗CIDP的可行性、耐受性和疗效,并强调了CAR-T细胞疗法在治疗复发/难治性自身免疫性疾病方面的潜力。这一策略有望为CIDP带来可治愈的治疗方法。相关研究结果于2024年5月28日在线发表在hLife期刊上,论文标题为“BCMA-CD19 bispecific CAR-T therapy in refractory chronic inflammatory demyelinating polyneuropathy”。
这些作者利用BCMA蛋白存在于浆母细胞(plasmablasts)和长寿命浆细胞的优势,设计出了同时靶向CD19和BCMA的双特异性CAR-T细胞,旨在通过暂时、深入地消灭B细胞和浆细胞来重置免疫反应的平衡。
一名44岁的复发性/难治性CIDP男性患者表现出肢体远端麻木和无力。根据 2021 年欧洲神经病学学会/外周神经病学学会 CIDP 指南,他被诊断为远端 CIDP,但无 IgG4 自身抗体。入院后经过评估和讨论,他符合接受治疗自身免疫性疾病的双特异性CAR-T疗法的条件,并成功接受了治疗。
接受 CAR-T 细胞治疗后,根据 INCAT 残疾和 MRC 评分,这名男性患者的功能有了显著改善。值得注意的是,在接受 CAR-T 治疗 180 天后,他的肌肉力量几乎完全恢复,可以重新行走。
4.JCO:1期临床试验表明一种增强型CAR-T细胞疗法有望治疗诸如弥漫性中线胶质瘤之类的高级别中枢神经系统肿瘤
doi:10.1200/JCO.23.02019
弥漫性中线胶质瘤(diffuse midline glioma, DMG)和其他复发性高级别中枢神经系统肿瘤是预后不良的侵袭性脑癌,儿童患者需要新的治疗方法。一种使用嵌合抗原受体(CAR)修饰的T细胞(CAR-T)的免疫疗法已在其他癌症中显示出疗效,但在DMG和其他中枢神经系统肿瘤中的应用还很有限。
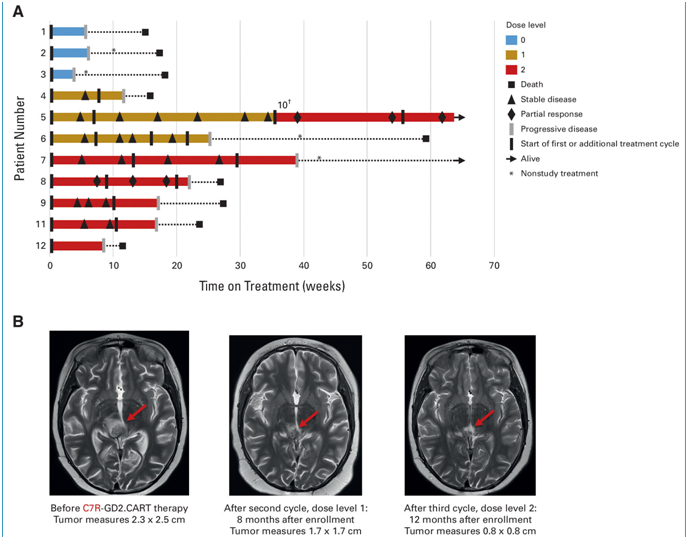
图片来自Journal of Clinical Oncology, 2024, doi:10.1200/JCO.23.02019
在一项新的研究中,来自德克萨斯儿童癌症中心、贝勒医学院细胞与基因治疗中心、德克萨斯儿童医院和休斯顿卫理公会医院的研究人员开发出一种靶向在DMG和其他中枢神经系统肿瘤中高度表达的GD2抗原的增强型CAR-T细胞疗法。在德克萨斯儿童癌症中心进行的1期临床试验中,患者对这种疗法的耐受性良好;一些患者的肿瘤相关神经功能缺损得到了暂时改善,值得进一步研究这种新型疗法。相关研究结果近期发表在Journal of Clinical Oncology期刊上,论文标题为“Phase I Trial of GD2.CART Cells Augmented With Constitutive Interleukin-7 Receptor for Treatment of High-Grade Pediatric CNS Tumors”。
德克萨斯儿童癌症中心肿瘤学家Bilal Omer博士说,“脑肿瘤具有很强的免疫抑制作用,能有效关闭CAR-T细胞。我们的目标是通过用一种名为C7R的受体改造GD2 CAR-T细胞来克服这一挑战。这项研究表明,这种疗法可以有效地进入肿瘤,而C7R的加入则安全地增强了抗肿瘤活性。”
5.Nat Immunol:我国科学家发现单次灌注分泌IL-4突变蛋白的长寿命CAR-T细胞有望持续缓解哮喘症状
doi:10.1038/s41590-024-01834-9
在一项新的研究中,来自中国清华大学的研究人员发现经过基因改造的长寿命多功能T细胞能抑制小鼠过敏性哮喘的症状和体征长达一年之久。具体而言,他们对CAR-T细胞进行基因改造使之降低与2型高特征哮喘(type 2 high-signature asthma)相关的白细胞介素的功能。相关研究结果发表在2024年6月的Nature Immunology期刊上,论文标题为“A single infusion of engineered long-lived and multifunctional T cells confers durable remission of asthma in mice”。
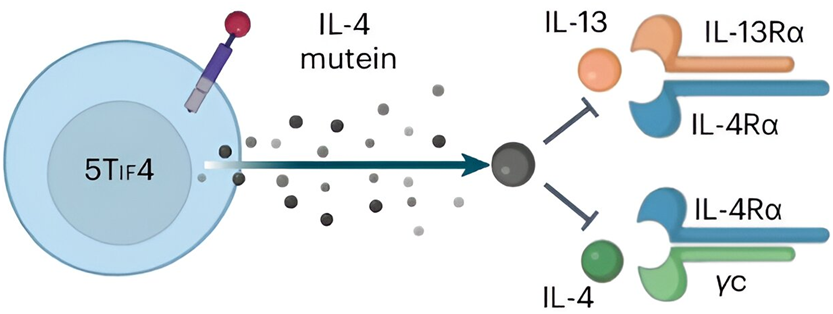
图片来自Nature Immunology, 2024, doi:10.1038/s41590-024-01834-9
哮喘是一种气道发炎、狭窄和肿胀的疾病;作为一种反应,肺部会产生过量粘液,导致呼吸困难。治疗这种疾病的方法通常是使用能够减轻炎症的吸入剂。医务工作者和患者都希望有更好的治疗方案。在这项新的研究中,这些作者可能找到了这样的一种治疗方案。
这些作者专注于减轻2型高特征哮喘的症状,这种哮喘通常与白细胞介素5(IL-5)驱动的嗜酸性粒细胞增多有关,嗜酸性粒细胞增多会导致粘液分泌增加。
CAR-T 细胞最常与抗癌联系在一起。但是,他们注意到,它很可能有助于治疗哮喘等其他疾病。他们利用 IL-5 作为靶向结构域,并剔除 BCOR 和 ZC3H12A,从而设计出能够消灭嗜酸性粒细胞的长寿命CAR-T 细胞。他们称这些细胞为长生不老的功能性 IL-5 CAR-T 细胞(5TIF)。他们对5TIF细胞进行进一步改造,使之能分泌一种能阻断IL-4和IL-13信号传导的IL-4突变蛋白(IL-4 mutein),因而将之命名为5TIF4细胞。在哮喘模型中,在完全免疫功能正常的小鼠中单次输注5TIF4细胞,无需任何调理方案,就能持续抑制肺部炎症并缓解哮喘症状。
6.NEJM:病例研究揭示了与CAR-T细胞治疗相关的罕见继发性癌症的重要新细节
doi:10.1056/NEJMoa2401361
在一项新的病例研究中,乔治城大学医学中心等研究机构的研究人员通过详细分析患者接受CAR-T细胞疗法治疗初始癌症后罹患的第二种癌症,提出了罕见但重要的见解,旨在为肿瘤学家和病理学家提供针对与CAR-T细胞相关的第二种癌症的临床表现和病理特征的有益指导。相关研究结果发表在2024年6月13日的NEJM期刊上,论文标题为“Risk of Second Tumors and T-Cell Lymphoma after CAR T-Cell Therapy”。
论文第一作者、乔治城大学医学院病理学教授Metin Ozdemirli 博士说,“CAR-T细胞治疗的既定价值及其对癌症患者的益处意义重大。我们的病例研究描述了一名接受CAR-T细胞疗法治疗的患者的罕见病例,为使用这种方法治疗患者的医生提供了非常有用的信息。有了我们的心见解,医生就能警惕类似的情况,并有可能更早地发现继发性肿瘤,更好地进行管理。”
在接受CAR-T细胞疗法治疗的约3万名患者中,报告的第二种癌症非常罕见;美国食品药品管理局(FDA)追踪了约25例CAR-T细胞治疗后出现第二种癌症(通常是淋巴瘤)的病例,这项病例研究中的这名患者在接受CAR-T细胞治疗后就发生了淋巴瘤。
在接受 CAR-T细胞疗法四个月后,这项病例研究中的这名患者出现了逐渐恶化的非血性腹泻,体重下降了 12 磅。血液化验结果显示,内窥镜检查发现十二指肠(小肠的第一部分)出现溃疡。这名患者接受了治疗,但症状依然存在,类似于自身免疫性疾病。经过多次额外检查后,活组织切片发现了罪魁祸首——胃肠道惰性T细胞淋巴瘤(indolent T-cell lymphoma),与其他病例类似,但进一步的分子分析表明这是一个CAR-T细胞阳性病例。
7.T细胞激活的'黄金平衡' Nat Immunol:T细胞受体与癌症相关抗原的结合强度决定着T细胞的抗癌活性和命运
doi:10.1038/s41590-024-01843-8
免疫疗法作为重振免疫细胞抗癌活性或引导T细胞消灭肿瘤细胞的策略,在白血病治疗上展现出良好的前景,但面对实体瘤时却成效不显著。阻止其发挥效果的原因之一是,潜在的杀癌 T 细胞在肿瘤附近会进入不活跃的“衰竭”状态。在一项新的研究中,来自圣犹大儿童研究医院的研究人员发现亲代 T 细胞捕获癌蛋白的紧密程度决定了其子细胞是成为抗癌效应细胞还是陷入衰竭状态。这些发现对改进免疫疗法具有广泛的意义。相关研究结果发表在2024年6月的Nature Immunology期刊上,论文标题为“Antitumor progenitor exhausted CD8+ T cells are sustained by TCR engagement”。
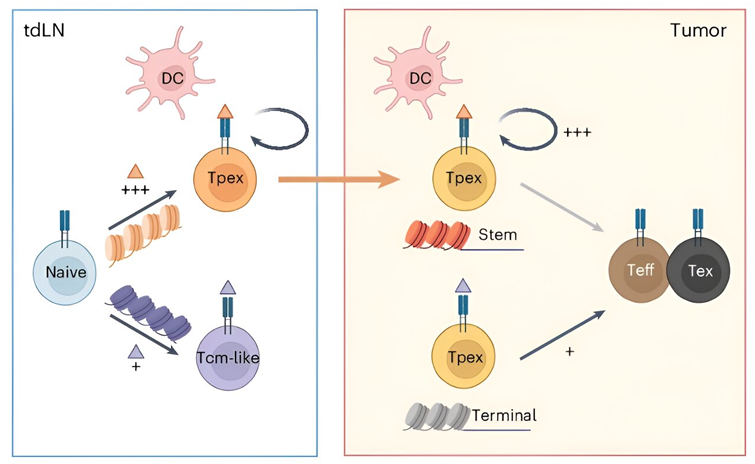
图片来自Nature Immunology, 2024, doi:10.1038/s41590-024-01843-8
论文通讯作者、圣犹大儿童研究医院免疫学系博士Benjamin Youngblood说,“我们发现,TCR的结合强度和信号强度需适中,过度激活会导致T细胞过早耗竭,减弱抗癌力;而激活不足同样令细胞功能失常。理想状态在于找到那个‘黄金平衡点’。”
8.Cell Stem Cell:利用iPS细胞产生的调节性T细胞成功抑制异种移植物抗宿主病
doi:10.1016/j.stem.2024.05.004
在一项新的研究中,日本京都大学的Shin Kaneko 教授及其团队成功地从诱导性多能干细胞(iPS)衍生的常规辅助性 T 细胞(conventional helper T cell, Tconvs)中诱导出了调节性 T 细胞(Treg)样细胞,并证明了它们抑制异种移植物抗宿主病(GvHD)的能力。相关研究结果发表在2024年6月6日的Cell Stem Cell期刊上,论文标题为“Human iPSC-derived CD4+ Treg-like cells engineered with chimeric antigen receptors control GvHD in a xenograft model”。
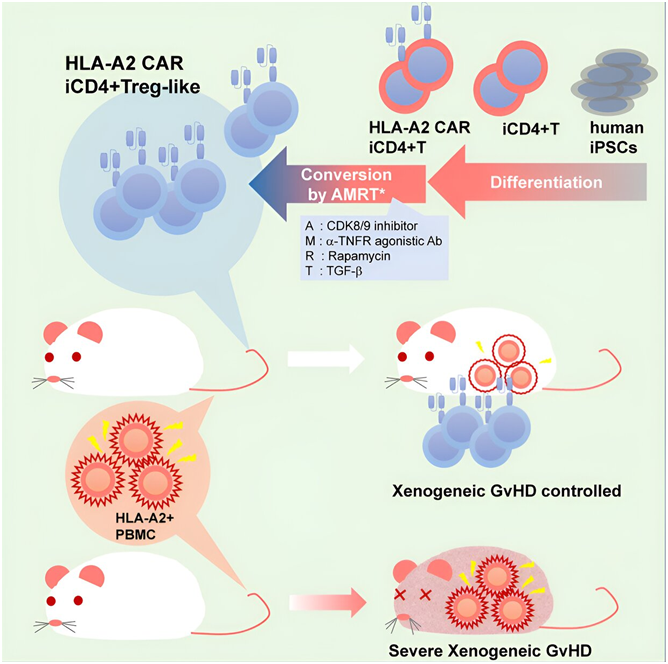
图片来自Cell Stem Cell, 2024, doi:10.1016/j.stem.2024.05.004
自身免疫性疾病(如类风湿性关节炎和重症肌无力)和移植物抗宿主病是由过度免疫反应引起的。免疫抑制性的Treg细胞可抑制这类不良的免疫反应,因此被视为治疗这些疾病的一种新型治疗策略。然而,如何在体外扩增Treg细胞以制造大量用于临床的Treg细胞,以及如何在移植前保持Treg细胞的免疫抑制活性,仍然是一项挑战。
这些作者一直致力于将iPS细胞再分化为T细胞,但传统方法主要产生的是细胞毒性T淋巴细胞(CTL)。根据近期报道的能够分化为CD4 辅助 T 细胞的人造胸腺类器官(artificial thymic organoid, ATO)系统,他们假设有可能将这些Tconvs 的一个亚群转化为 Treg细胞。虽然他们利用 ATO 系统成功地将 iPS 细胞分化为 CD4 T 细胞(iCD4+ T 细胞),但他们也注意到,分化出的细胞并没有表达太多FOXP3,即Treg细胞的一种主转录因子。
为了诱导这些 iCD4+ T 细胞转化为 Treg细胞,这些作者用以下化学物和细胞因子组合处理了它们 14 天:单用IL-2、IL-2 +AS2863619 +雷帕霉素(AR)、IL-2 + AS2863619 +雷帕霉素 + TGF-β(ART)、IL-2 + AS2863619 + MR2-1 + TGF-β(AMT)和IL-2 + AS2863619 + MR2-1 +雷帕霉素+ TGF-β(AMRT)。
这些作者测试了这些混合物诱导 iCD4+ T 细胞中 FOXP3 表达的能力,其中 AMRT 处理对 FOXP3 的诱导作用最强。由于FOXP3在人类T细胞活化过程中也会被诱导,他们还检测了另一种标志物——FOXP3 CNS2(Treg细胞特异性的一个去甲基化区),以清楚地表明FOXP3+ Treg细胞是否成功产生。
doi:10.1038/s43018-024-00768-3
用于治疗B细胞恶性肿瘤的嵌合抗原受体(CAR, chimeric antigen receptor)T细胞能识别具有优越临床活性的T细胞亚群。近日,一篇发表在国际杂志Nature Cancer上题为“Identification of a clinically efficacious CAR T cell subset in diffuse large B cell lymphoma by dynamic multidimensional single-cell profiling”的研究报告中,来自休斯顿大学等机构的科学家们通过研究发现了一类新型T细胞亚群,其或能改善接受T细胞治疗的患者的预后。
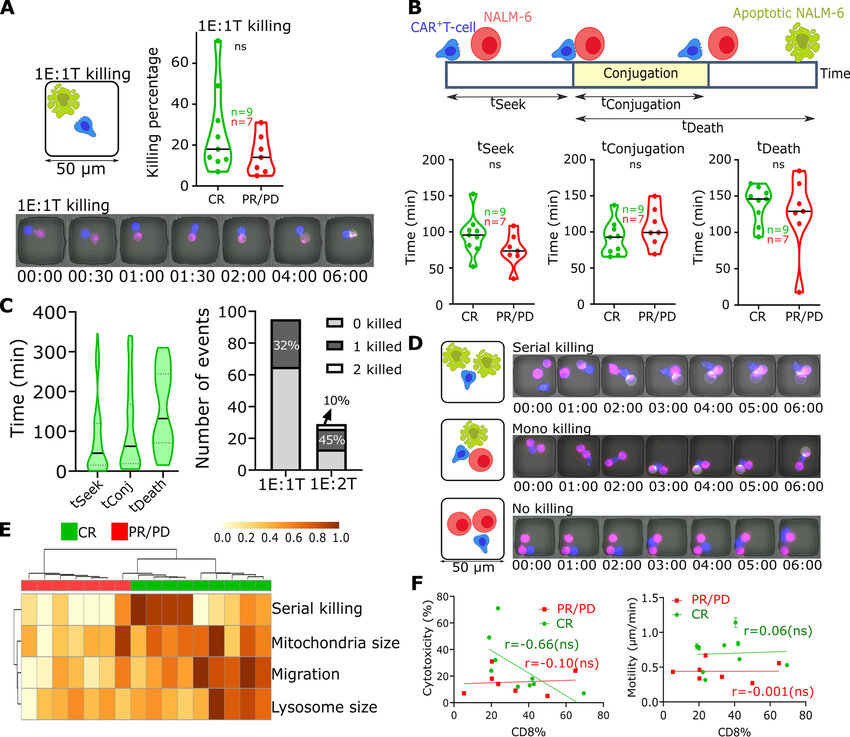
科学家发现最佳的抗癌T细胞亚群。图片来源:Nature Cancer (2024). DOI:10.1038/s43018-024-00768-3
基于T细胞的免疫疗法在抵御并消除癌症上表现出了巨大的价值,而这一策略也能激活患者机体的免疫系统并工程化改造患者自身的T细胞从而识别、攻击并杀灭癌细胞,这样机体自身的T细胞就能变成活的药物。尽管T细胞疗法已经彻底改变了人类癌症的治疗,但仍然还有很多东西需要科学家们去钻研探究,不幸的是,并不是所有患者都对这些疗法能产生反应,因此,更好地理解工程化T细胞的特性对于改善患者的临床反应就显得非常必要了。
这项研究中,研究人员使用了TIMING(纳米阱网格延时成像显微镜技术,Timelapse Imaging Microscopy in Nanowell Grids)方法,其能应用视觉AI来评估细胞的行为、运动和杀伤能力。研究结果表明,被标记为CD8合身T细胞的T细胞亚群具有高度的运动型和连续杀伤能力,其其能在有临床反应的患者中被发现。为了发现CD8合身细胞(CD8-fit cells),研究人员利用TIMING来追踪数千个细胞中单一T细胞和肿瘤细胞之间的相互作用,并将结果与单细胞RNA测序数据进行结合分析。
研究者Rezvan说道,CAR-T细胞能以优越的临床活性来识别T细胞亚群,利用大B细胞淋巴瘤患者的输注产品,我们就能将利用TIMING将功能分析与亚细胞分析和单细胞RNA测序技术相结合来识别多功能CD8 T细胞(CD8合身T细胞)的特征。研究人员使用单细胞RNA测序技术对这些细胞进行分析,从而识别出CD8合身分子特征,该特征能被用于预测T细胞疗法治疗的持久性患者治疗结局,并能通过独立的数据库来验证研究人员的发现。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


