Nature子刊:四川大学魏霞蔚等开发了一种多组分鼻内疫苗
来源:iNature 2025-09-27 17:07
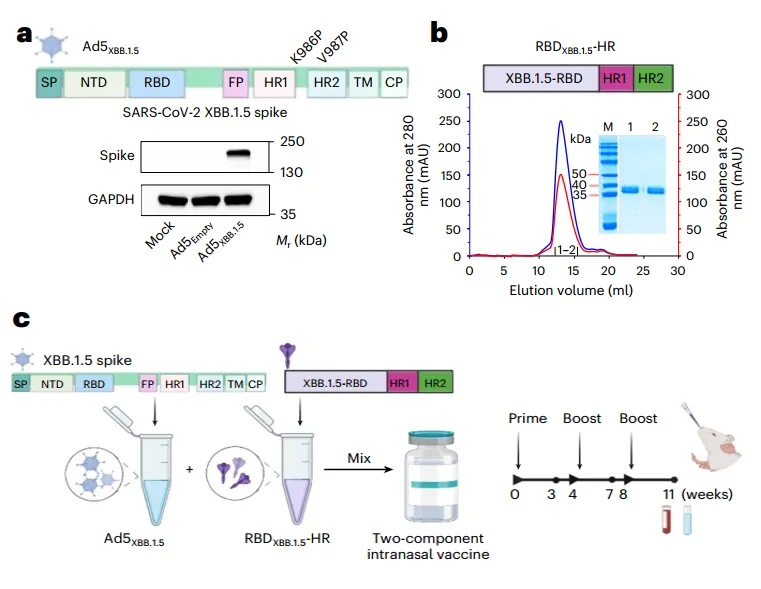
该研究开发了一种双组分鼻内疫苗,该疫苗将表达XBB.1.5变体刺突蛋白(Ad5XBB.1.5)的腺病毒载体与源自受体结合结构域的自组装三聚体重组蛋白(RBDXBB.15-HR)结合在一起。
粘膜免疫可有效防止上呼吸道感染,限制病毒的脱落和传播。然而,目前,世界卫生组织没有批准任何鼻喷新冠肺炎疫苗在全球使用。
2025年9月22日,四川大学魏霞蔚、李为民、Yang Li、 Lu Guangwen、中国医学科学院王佑春、孙强明、鲁帅尧共同通讯在Nature Biomedical Engineering在线发表题为“Intranasal vaccine combining adenovirus and trimeric subunit protein provides superior immunity against SARS-CoV-2 Omicron variant”的研究论文,该研究开发了一种双组分鼻内疫苗,该疫苗将表达XBB.1.5变体刺突蛋白(Ad5XBB.1.5)的腺病毒载体与源自受体结合结构域的自组装三聚体重组蛋白(RBDXBB.15-HR)结合在一起。
严重急性呼吸系统综合征冠状病毒2型的奥密克戎变异株(B.1.1.529)继续在全球传播,并已多样化为各种亚变异株。其中,以增强免疫逃避而闻名的XBB谱系产生了XBB.1.5、XBB.1.16、EG.5.1和HV.1等子变体。最近,BA.2.86的亚变体,包括JN.1、KP.2和KP.3,也出现了,并在全球范围内竞争。鉴于它们对以前接种疫苗和感染的中和抗体的抵抗力,以及免疫印迹的潜在影响,FDA建议在下一代疫苗中使用XBB后代谱系的抗原。
为了提高呼吸道病毒疫苗的有效性,优化疫苗输送以产生强大的粘膜免疫反应至关重要。目前,大多数被批准紧急使用的新冠肺炎疫苗都是肌肉注射的,可以预防有症状的感染和严重疾病。然而,这些疫苗可能无法完全预防严重急性呼吸系统综合征冠状病毒2型的脱落和传播,因为它不能有效地诱导上呼吸道的粘膜免疫,导致无症状或较轻的感染,这些感染仍然可以传播病毒。
 疫苗设计原理图(图源自Nature Biomedical Engineering)
疫苗设计原理图(图源自Nature Biomedical Engineering)
已经进行了巨大的努力来开发下一代鼻内新冠肺炎疫苗。人们正在探索各种平台,包括病毒载体(如腺病毒、减毒活流感病毒、副流感病毒、呼吸道合胞病毒和新城疫病毒)、佐剂蛋白方法(使用多聚体、膜泡、纳米颗粒和Toll样受体激动剂)以及基于核酸的疫苗(DNA和RNA)。这些不同的策略目前正在临床前研究中,以促进鼻内疫苗的开发。目前,十多种鼻内疫苗候选物正在临床研究中,但没有一种获得世界卫生组织批准在全球使用。有效的鼻内新型冠状病毒疫苗应该理想地刺激粘膜和全身免疫反应,导致中和抗体的产生,从而抑制传播并预防有症状和严重的疾病。
在这项研究中,研究人员开发了一种携带XBB.1.5刺突蛋白(Ad5XBB.1.5)的腺病毒载体,并使用刺突七肽重复序列(HR)生产了源自XBB.1.5和BA.5的自组装三聚体蛋白(RBDXBB.1.5-HR和RBDBA.5-HR)。然后,将腺病毒和蛋白质抗原混合,配制出双组分(Ad5XBB.1.5 + RBDXBB.1.5-HR)和三组分(Ad5XBB.1.5) + RBDXBB.1.5-HR + RBDBA.5-HR)疫苗。
与单独的腺病毒载体相比,这些多组分疫苗诱导了优异的细胞和体液免疫反应,有效地中和了XBB谱系变异。三组分疫苗进一步增强了对更广泛的奥密克戎亚变异株的交叉中和反应,无论是作为独立疫苗还是顺序加强剂,都突显了其作为多价疫苗平台的潜力。从机制上讲,STING信号通路的激活,特别是在粘膜树突状细胞中,对于腺病毒载体诱导的佐剂效应至关重要。双组分疫苗的鼻内给药在动物模型中提供了对活XBB谱系病毒挑战和传播的有效保护。在人类参与者中,双组分疫苗表现出良好的耐受性和安全性,同时改善了全身和粘膜抗体反应。
参考信息:
https://www.nature.com/articles/s41551-025-01517-2#Sec27
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


