Sci Signal: 白三烯依赖性脾-肝轴在系统性炎症中驱动TNF-a的产生
来源:本站原创 2021-04-25 03:29
要想实现有效的宿主免疫,同时而不会引起附带组织损伤,依赖于促炎性细胞因子“肿瘤坏死因子(TNF)”产生的精确调节。在最近一项研究中,来自巴西圣保罗大学的Alexandre A. Steiner团队揭示了在由细菌脂多糖(LPS)诱发的系统性炎症的大鼠模型中,脾-肝轴驱动TNF产生的机制。相关结果发表在《Science Signaling》杂志上。
2021年4月25日讯/生物谷BIOON/---要想实现有效的宿主免疫,同时而不会引起附带组织损伤,依赖于促炎性细胞因子“肿瘤坏死因子(TNF)”产生的精确调节。在最近一项研究中,来自巴西圣保罗大学的Alexandre A. Steiner团队揭示了在由细菌脂多糖(LPS)诱发的系统性炎症的大鼠模型中,脾-肝轴驱动TNF产生的机制。相关结果发表在《Science Signaling》杂志上。
(图片来源:www.pixabay.com)
在该研究中,作者首先评估了LPS诱发的系统性炎症大鼠模型中脾脏和肝脏对TNF产生的相对贡献,以及在TNF产生的背景下这些器官之间是否存在相互依赖性。对此,作者将来自大肠杆菌O55:B5的LPS或对照生理盐水静脉注射到未麻醉的雄性Wistar大鼠中。注射后30或80分钟,收集脾脏,肝脏和肺脏样本进行细胞因子基因表达分析。作者通RT-PCR)评估基因表达,并且通过每个目标基因的预期大小的单个扩增子的产量验证了PCR的准确性。在注射对照生理盐水的大鼠中,与脾脏和肝脏相比,肺中Tnf的表达最高。在LPS注射30分钟后接受检测的所有器官中,Tnf在肝脏与脾脏的表达处于相似水平,但是LPS显著增强了TNF在肺中的表达。 LPS注射80分钟后,肝和脾之间的Tnf表达没有差异,尽管肺中Tnf的表达仍旧高于肝脏,但这种器官间的差异不再明显。关于其他细胞因子,在LPS后至少一个时间点,肝脏和肺中的Il1b和Il10表达高于脾脏,而在注射盐水的对照组中,这些细胞因子在各器官间的表达没有差异。
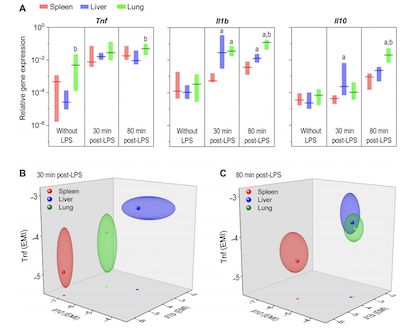
为了进行细胞水平的分析,作者比较了分离自脾脏,肝脏或肺脏的常驻巨噬细胞培养物中细胞因子的表达和分泌情况。结果显示:LPS刺激导致所有的巨噬细胞Tnf表达在统计学上均显著增加,就Tnf表达而言,肺(肺泡)巨噬细胞表达水平仅次于Kupffer细胞。 脾巨噬细胞中Tnf的表达至少比Kupffer细胞低250倍,比肺泡巨噬细胞中的Tnf低至少50倍。
为了直接评估肝脏对LPS诱导的细胞因子产生的贡献,在LPS刺激之前作者给小鼠进行了部分肝切除术。去除了占肝脏质量约70%的肝脏的中叶和左侧叶,而保留了右侧叶和尾状叶以及它们的血管连接。为了避免重要的肝功能丧失风险,作者在大鼠肝切除或对照手术后立即在麻醉下进行实验。与对照组相比,LPS诱导的血浆TNF激增效应在肝切除的大鼠中减少了32%。这种减少与其余器官(脾和肺)中Tnf表达的抑制没有关系。因此,肝切除术导致的血浆TNF的降低反映了肝脏本身对该细胞因子的产生的贡献。

(图1,LPS刺激引发各器官细胞因子产生水平分析)
因为基因表达的增加是细胞因子产生和分泌的关键步骤,即使IL-1β分泌依赖于炎症小体,基因表达水平的提升也是其必要条件。因此,上述结果表明脾脏并非唯一的促炎性因子产生源地,而应当将肝脏和肺同样作为炎症细胞因子的来源。

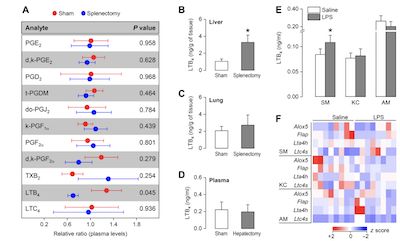
(图2,白三烯调节大鼠脾-肝轴交流以及TNF的产生)
为了进行细胞水平的分析,作者比较了分离自脾脏,肝脏或肺脏的常驻巨噬细胞培养物中细胞因子的表达和分泌情况。结果显示:LPS刺激导致所有的巨噬细胞Tnf表达在统计学上均显著增加,就Tnf表达而言,肺(肺泡)巨噬细胞表达水平仅次于Kupffer细胞。 脾巨噬细胞中Tnf的表达至少比Kupffer细胞低250倍,比肺泡巨噬细胞中的Tnf低至少50倍。
为了直接评估肝脏对LPS诱导的细胞因子产生的贡献,在LPS刺激之前作者给小鼠进行了部分肝切除术。去除了占肝脏质量约70%的肝脏的中叶和左侧叶,而保留了右侧叶和尾状叶以及它们的血管连接。为了避免重要的肝功能丧失风险,作者在大鼠肝切除或对照手术后立即在麻醉下进行实验。与对照组相比,LPS诱导的血浆TNF激增效应在肝切除的大鼠中减少了32%。这种减少与其余器官(脾和肺)中Tnf表达的抑制没有关系。因此,肝切除术导致的血浆TNF的降低反映了肝脏本身对该细胞因子的产生的贡献。
最终,作者发现脾脏中分泌的白三烯B4(LTB4)是驱动TNF产生的关键因素,进而揭示了“脾-肝轴”在调控系统性炎症反应中的作用。结合脾切除术和肝切除术对细胞因子表达和分泌的分析表明,脾脏不仅产生TNF,而且还产生促进肝脏分泌TNF的上游因子。基于质谱的脂质组学分析结果表明,白三烯B4(LTB4)是脾-肝轴中的信使分子。 LTB4对于体内脾-肝通讯以及体外脾巨噬细胞等之间的体液信号传递至关重要。 LPS刺激脾脏巨噬细胞分泌LTB4,从而使Kupffer细胞响应LPS以依赖LTB4受体的方式分泌更多的TNF。这些发现对于进一步了解各个器官如何相互沟通,以调节全身性炎症反应提供了新的思路。(生物谷 Bioon.com)
原始出处:Monique T. Fonseca, Eduardo H. Moretti, Lucas M. M. et al., A leukotriene-dependent spleen-liver axis drives TNF production in systemic inflammation. Science Signaling 20 Apr 2021:
Vol. 14, Issue 679, eabb0969 DOI: 10.1126/scisignal.abb0969
Vol. 14, Issue 679, eabb0969 DOI: 10.1126/scisignal.abb0969
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


