Nat Chem | 北京大学刘志博团队在放疗响应药物领域获新进展
来源:生物世界 2024-04-05 13:06
该研究设计了一种氨基甲酸酯连接剂,可以很容易地释放辐射中的荧光团和毒素。在活细胞和荷瘤小鼠中进行的实验可能会激发下一代ADCs的发展,这些ADCs具有更高的稳定性和治疗效果。
北京大学/昌平实验室刘志博团队(傅群峰,顾郅及申思涌为该文章的共同第一作者)在Nature Chemistry 在线发表题为“Radiotherapy activates picolinium prodrugs in tumours”的研究论文,该研究提出了成熟的光致电子转移化学可以为开发多功能辐射可移动保护基团铺平道路。利用功能报告分析,N-烷基-4-picolinium (NAP)被确定为一个笼化基团,通过释放客户分子有效地响应辐射。在竞争性实验中进行评估时,NAP部分比迄今发现的其他防辐射防护基团更有效。
利用这一特性,开发了一种NAP衍生的氨基甲酸酯连接剂,该连接剂在辐射下释放荧光团和毒素,并将其纳入抗体-药物偶联物(ADCs)中。这些设计的ADCs在活细胞和载瘤小鼠中具有活性,突出了使用这种可去除辐射的保护组来开发具有更高稳定性和治疗效果的下一代ADCs的潜力。该工作填补了从光化学到辐射化学领域过渡的技术空白,进一步扩充放疗射线响应的活性基团范围。
超过50%的癌症病例需要放射治疗,即使用电离辐射杀死癌细胞。电离辐射,包括X射线和γ射线,具有高组织穿透和小散射的特点。现代放射治疗技术能够实现“三维适形”肿瘤靶向,向肿瘤提供高剂量的辐射,同时对肿瘤周围的健康组织造成最小的损害。放射治疗的临床相关性、高组织穿透性和肿瘤靶向性使X射线(或γ射线)成为控制药物释放策略的最佳外源刺激。
尽管在20世纪90年代报道了使用放疗进行前药激活的策略,但由于效率低和化学选择性问题,在体内的应用受到限制。在肿瘤中,放疗主要电离水而不是前药分子,后者的浓度较低。羟基自由基(·OH)、氢自由基(H·)和水合电子(e-aq)是水放射性分解的主要产物。近年来,由·OH、H·或e-aq介导的几种可消除辐射的基团。已被开发并用于肿瘤的前药激活。值得注意的是,放疗激活前药策略在药物研发中得到了迅速的应用,包括PROTAC、药物偶联物等。这些研究包括使用可去除辐射的保护基团来设计前药。在接受放射治疗时,可以选择性地去除保护基团,促进药物活性的恢复。该策略旨在精确激活肿瘤内的药物,从而最大限度地减少化疗的相关副作用。然而,开发具有更高反应效率的可去除辐射的保护基团是进一步在体内应用的需要。
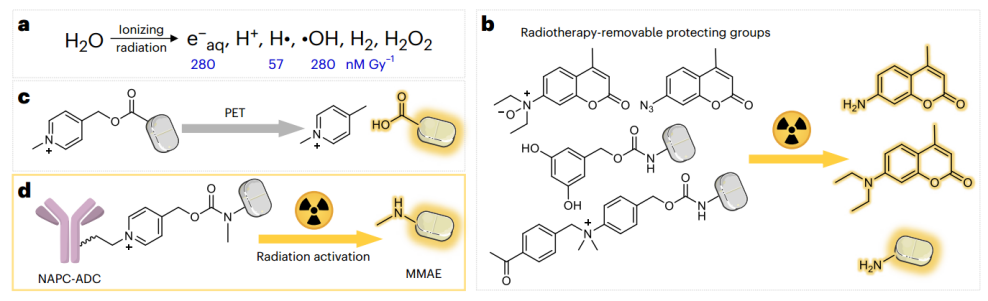
辐射诱导的NAP片段激活释放功能分子(Credit: Nature Chemistry)
放射化学过程中,可去除辐射的基团捕获e-aq以提供阴离子自由基中间体,类似于光诱导电子转移(PET)的单电子转移过程。PET诱导的卵裂反应通过电子从光激发敏化基团转移到保护基团,然后是去保护,已经广泛应用于功能分子的控制释放,如肽合成、蛋白质调节和前药激活。因此,通过PET还原失去保护的光可拆卸保护基团是否可以通过放射治疗激活并控制释放。
综上所述,该研究开发了一种受PET启发的放射治疗诱导的前药激活策略。一项竞争性的分析表明,NAP片段是迄今为止最有效的放射治疗可移动保护组,并且在生理条件下对e-aq的反应性比先前的研究更高。该研究设计了一种氨基甲酸酯连接剂,可以很容易地释放辐射中的荧光团和毒素。在活细胞和荷瘤小鼠中进行的实验可能会激发下一代ADCs的发展,这些ADCs具有更高的稳定性和治疗效果。该策略有望通过结合免疫疗法来治疗难以切除的肿瘤,以满足未满足的临床需求。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


