中国医学科学院研究者揭示了针对胍基乙酸铵代谢和表观遗传调控机制的潜在治疗策略
来源:生物谷原创 2023-07-13 17:21
胰腺导管腺癌(PDAC)是一种高度恶性的消化系统肿瘤,占胰腺外分泌恶性肿瘤的85%以上。只有大约10%的确诊PDAC患者有资格接受根治性切除,而大多数患者被诊断为晚期疾病。
胰腺导管腺癌(PDAC)是一种高度恶性的消化系统肿瘤,占胰腺外分泌恶性肿瘤的85%以上。只有大约10%的确诊PDAC患者有资格接受根治性切除,而大多数患者被诊断为晚期疾病。值得注意的是,PDAC倾向于转移到肝脏,在新诊断的PDAC病例中有35%发现有肝转移。
在复发或转移的患者中,47.6%的患者在术后6个月内发生肝转移。转移导致PDAC患者预后不良,导致不良的治疗效果。

图片来源: https://doi.org/10.1186/s13046-023-02698-x
近日,来自中国医学科学院的研究者们在J Exp Clin Cancer Res杂志上发表了题为“Epigenetic reprogramming-induced guanidinoacetic acid synthesis promotes pancreatic cancer metastasis and transcription-activating histone modifications”的文章,该研究发现揭示了表观基因组-代谢组相互作用在调控PDAC肝转移中的关键作用,并提出了针对GAA代谢和表观遗传调控机制的潜在治疗策略。
胰腺导管腺癌(PDAC)易发生远处转移,尤其是肝转移,预后不良。代谢重塑和表观遗传重编程是恶性肿瘤的两个重要标志,并参与调控PDAC肿瘤的发生和转移。然而,这两个过程在PDAC转移过程中的相互作用还没有完全阐明。
研究者进行了代谢组学分析,以确定与PDAC肝转移相关的关键代谢物,并将重点放在胍基乙酸(GAA)上。在小鼠异种移植瘤模型中,肝转移的PDAC细胞的细胞内GAA含量显著高于原代癌细胞。在不同的细胞和动物模型中,通过分析细胞迁移、丝状足形成、上皮-间充质转化(EMT)和体内转移来评价补充GAA和甘氨酸氨基转移酶(GATM)基因敲除对PDAC转移的影响。
然后,通过芯片-qPCR、3C-qPCR和CRISPRi/dCas9-KRAb实验来验证“表观组-代谢组”机制,最后,体外实验的结果,包括RNA-seq、Cut&Run、RT-qPCR和Western印迹分析,以及荧光素酶报告基因分析和Transwell分析,揭示了GAA-cMyc-HMGA轴和转录激活组蛋白修饰的重编程。
细胞内高水平的GAA与PDAC肝转移相关。GAA在体内外均能促进胰腺癌细胞的迁移、EMT和肝转移。接下来,研究者探讨了GATM介导的从头合成GAA在胰腺癌转移中的作用。GATM的高表达与PDAC的N分期呈正相关。GATM基因敲除可显著降低细胞内GAA水平,抑制EMT,抑制PDAC肝转移,这些作用可被GAA减弱。
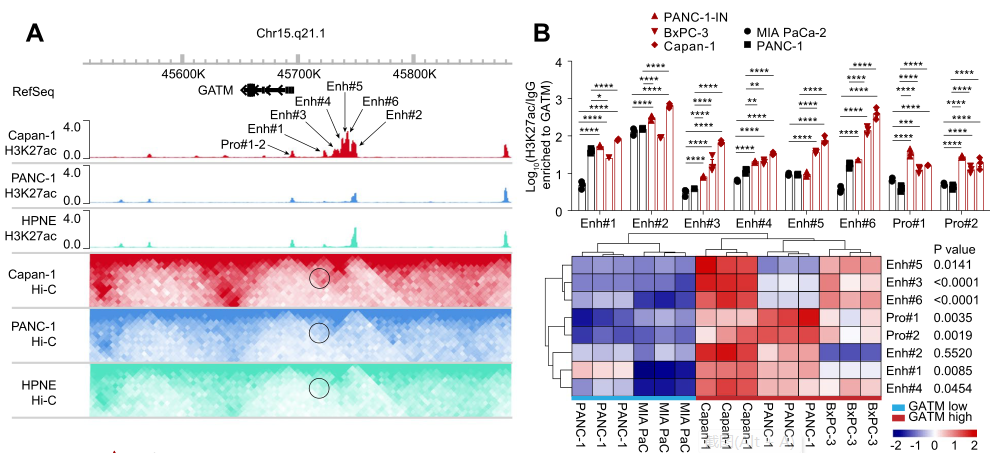
在机制上,研究者发现了与Gatm基因位点相连的活性增强子,促进Gatm表达和PDAC肝转移。此外,研究者还发现GAA通过调节c-Myc介导的高迁移率族AT-Hook蛋白的表达来促进细胞迁移和EMT。此外,GAA通过上调组蛋白甲基转移酶来上调H3K4me3的修饰水平,从而诱导包括Myc在内的转移相关基因的转录。
GAA代谢通过上调MYC的表达促进HMGA诱导的EMT
图片来源: https://doi.org/10.1186/s13046-023-02698-x
综上所述,本研究结果表明,3D表基因组重编程诱导的GAA合成增强可能通过促进c-Myc介导的HMGA蛋白表达和重编程转录激活的组蛋白修饰来促进PDAC肝转移,表明胰腺癌肝转移过程中两个重要的癌症标志-代谢重塑和表观遗传重编程之间存在密切而复杂的关系。
在未来,需要确定胰腺癌转移过程中与表观遗传重编程相互作用的无数变化的代谢物。针对表观基因组-代谢组相互作用程序的新策略的开发可能有助于对抗远处转移,改善胰腺癌患者的生存结果。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


