Nature子刊:口服胰岛素研究获突破
来源:生辉 2022-12-16 11:44
在糖尿病研究领域,科学家长期致力于寻求一种能够替代胰岛素的分子,想要以此制造出口服的胰岛素药物,从而取代注射胰岛素。
在糖尿病研究领域,科学家长期致力于寻求一种能够替代胰岛素的分子,想要以此制造出口服的胰岛素药物,从而取代注射胰岛素。
制备口服胰岛素的阻碍主要是由于胰岛素是一种典型的蛋白质,而动物的消化道内充斥着胃蛋白酶、胰蛋白酶、蛋白水解酶等各种酶类。因此经口服的胰岛素会在消化道内被消化吸收,完全起不到降糖的作用。
“自从一百年前胰岛素被发现以来,开发胰岛素药丸一直是糖尿病研究人员的梦想,然而经过数十年的尝试,人们在该研究道路上一直收效甚微。”来自澳大利亚 WEHI 医学研究所(以下简称“WEHI”)的高级研究员 Nicholas Kirk 介绍道。
不过,随着冷冻电子显微镜(cryo EM)的发展,对于胰岛素替代分子的研究或将得到显著加速。日前,在一项由 WEHI 的 Nicholas Kirk 与 Michael Lawrence 教授领导的最新研究中,研究团队使用冷冻电镜展示了一些胰岛素模拟分子作用于胰岛素受体的 3D 图像。该研究证实,使用胰岛素的替代分子可以激活胰岛素受体从而吸收葡萄糖,完全绕过了对于胰岛素的需求。
该研究同时与美国制药公司礼来的部分研究人员合作,论文以:Activation of the human insulin receptor by non-insulin-related peptides 为题发表于 Nature Communications 期刊。

总体而言,该项研究通过图像精确地获知了胰岛素模拟分子如何激活胰岛素受体从而调节血糖水平,该进展为开发用于替代 1 型糖尿病患者的注射胰岛素药物开辟了新途径。
用“简单的分子”模拟胰岛素
在人体代谢方面,人胰岛素受体(hIR)在调节葡萄糖稳态方面起到关键作用。人胰岛素受体属于受体酪氨酸激酶类,其能够由胰岛素、类胰岛素一号生长因子(IGF-I)、类胰岛素二号生长因子(IGF-II)等激活。
长期以来,众多研究人员致力于寻找更多种能够激活胰岛素受体通路的分子。2002 年,一项发布于 Mechanisms of Signal Transduction 的论文表明,一些非胰岛素相关的肽家族在动物模型中既可以激活胰岛素受体通路,又可以降低血糖水平。这一发现为胰岛素替代药物的挖掘点燃了希望。
早期的研究者将胰岛素和胰岛素受体之间的结合进一步拆解成为蛋白质之间的相互作用,并且针对胰岛素受体表面的关键作用位点展开探索。其中,一种特殊的融合肽(同时具有 site 1 和 site 2 结构)被认为是 IR 激动剂。然而,由于缺乏对该类融合肽如何结合并激活 hIR 实际构象的了解,研究人员很难对这些肽家族展开进一步的开发工作。
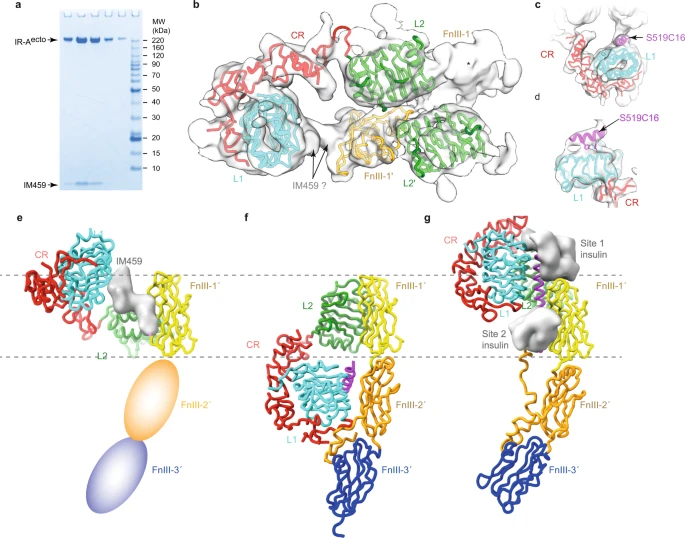
在最新研究中,研究团队展示了两种 IR 激动剂,即 IM459 和 IM172 与胰岛素受体相互作用的高分辨率视图。基于单粒子冷冻电子显微镜图像表明,IM459 能够将 hIR 结构域 L1 与 hIR 结构域 FnIII-1' 交联,而 IM172 的 Site 2 组分(“IM172N22”)则能够与 hIR 胞外域复合。总之,这些数据阐明了开发可用于治疗糖尿病的新型 hIR 激动剂的途径。
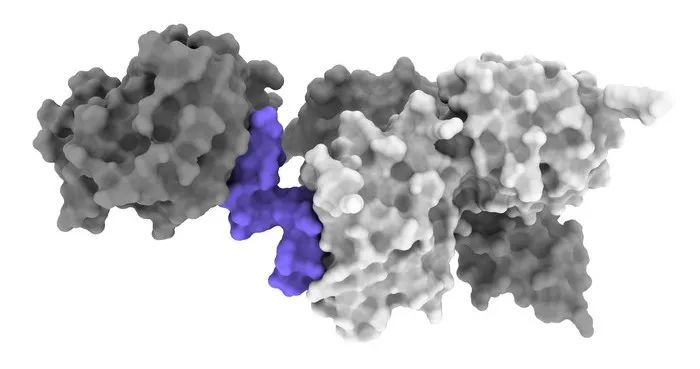
▲图丨胰岛素模拟分子(紫色)与部分胰岛素受体(灰色)相互作用的 3D 图像。一旦受体被激活,当身体的糖水平过高时,受体就会引导细胞吸收葡萄糖(来源:WEHI)
具体到两种分子上看,对于 IM459 复合胰岛素受体的图像研究是基于肽和被称为 hIR-Aecto 的受体结合域构建图像。该图像中呈现出两个管状密度特征,夹在结构域 L1 和 FnIII-1' 之间。其中,首个管状密度特征经分析认为是 IM459 的 site 1 组件,域 FnIII-1' 上的第二个管状密度特征被暂时解释为 IM459 的 site 2 组件,其结构可能呈螺旋构象。
▲图丨IM459 结合 hIR-Aecto 的冷冻电镜图
对于 IM172 而言,研究团队未能获得与其 site 2 结构 IM172N22 复合的 IR 胞外域图像。不过,在将 IM172N22 绑定到与胰岛素和单克隆抗体 83-7 的可变结构域进行预复合后发现,其与 IR 上多个位点发生相互作用,并且与结构域 FnIII-1 的相互作用十分稳定,其螺旋二级结构保持完整。
总体而言,这些分子能够与胰岛素受体相互作用,并将其保持在“活性”位置。“我们使用的肽能够成对地激活胰岛素受体,就像一只手将钳子夹在一起。”Kirk 对此介绍道。
从生化角度来看,IM459 与 IM172 对于 hIR 的亲和力与生物合成的人胰岛素具有相当的水平,但它们的结构中包含能够降低蛋白水解敏感性的突变,这就使得其在稳定性方面具有优势。
多种 1 型糖尿病的简便疗法获得快速进展
“事实证明,胰岛素与受体之间的相互作用比人们预测的要复杂得多,胰岛素及其受体在合作时会发生巨大的形状变化。”Kirk 表示,“借助冷冻电镜,我们现在可以直接比较包括胰岛素在内的不同分子如何与胰岛素受体发生作用。”
尽管该项研究成果距离落地转化与治疗还很遥远,但其发现或将为 1 型糖尿病口服药物的研究打开大门,从而减少糖尿病患者对注射的需求。
多年以来,科学家始终致力于为 1 型糖尿病患者带来更加便捷的治疗方式。
今年 11 月,澳大利亚政府向 Garvan 医学研究所提供了数亿美金,以支持 1 型糖尿病基因疗法研究。据悉,该项研究是全球首次将工程化胰岛细胞移植到人类体内以治疗 1 型糖尿病的临床试验,旨在通过 GARV-AAV2-A20 病毒递送系统,将制造 A20 的基因转运到供体胰岛细胞中,然后移植到患者体内以达到治疗目的。
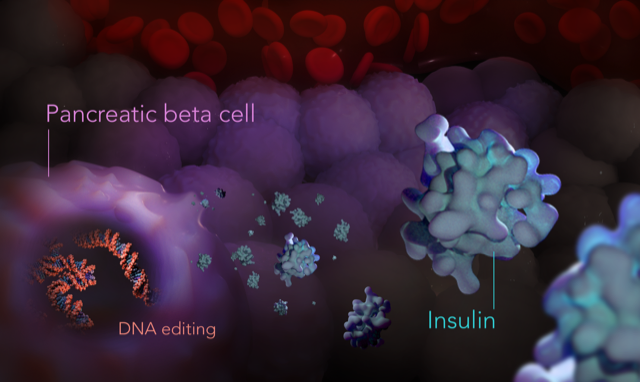
▲图丨胰腺 β 细胞产生调节血糖水平的胰岛素(来源:Garvan 研究所)
Garvan 研究所移植免疫学实验室负责人、首席研究员 Shane Grey 及其团队发现,一种名为 A20 的蛋白质参与自身免疫性疾病的发生,并对人体免疫系统具有调节作用。Grey 教授因此指出,可以通过 A20 抑制机体免疫系统,从而阻止其对胰岛细胞的损害并治疗 1 型糖尿病。
虽然该基因疗法有望减少患者对于胰岛素的依赖,然而移植的胰岛细胞的有效性通常会在五年内消退。此外,还需要免疫抑制剂来帮助减少排异的风险,但这会使患者容易受到严重的副作用,包括感染和肾脏损伤。
除了基因疗法之外,通过药物延缓 1 型糖尿病的发作成为了另一种治疗策略。同样在 11 月,纳斯达克上市公司 Provention Bio Inc.(Nasdaq:PRVB,以下简称为“Provention Bio”)旗下药物 TZIELD(teplizumab)获得了 FDA 批准,成为了首个也是唯一一个用于延缓儿童和成人 1 型糖尿病(T1D)病程的免疫调节剂。
TZIELD 是一种靶向 CD3 的抗体药物,通过静脉内注射给药,可通过使已对胰腺 β 细胞发生自身反应的淋巴细胞失活来延缓 T1D III 期症状的发作。
据 Provention Bio 联合创始人兼首席执行官 Ashleigh Palmer 介绍,TZIELD 是通过阻止自身免疫疾病过程和潜在的 β 细胞破坏,在症状出现之前延缓了疾病的发生。这种治疗实质上是重新启动免疫系统,保留了 β 细胞功能。
根据官方资料,TZIELD 注射液是无菌、无防腐剂、透明无色溶液,装在 2 mg/2 mL(1 mg/mL)单剂量小瓶中,应通过静脉输注(至少 30 分钟以上),每天一次,持续 14 天。目前,每瓶 TZIELD 的售价为 13,850 美元,14 瓶的定价是 193,900 美元。显然,该价格令部分潜在患者望而生畏。
近期,部分针对 1 型糖尿病的研究表明,同一疾病在不同患者之间存在疾病生理学的异质性。因此,患者将更加需要那些能够适应个性化方案的治疗策略,而口服用药或将成为其中一项有力的解决途径。相关研究者指出,“我们需要制定多种策略来针对血糖、血糖波动、低血糖并调整胰岛素剂量,这些策略可以根据 1 型患者的异质生理学和患者偏好进行调整。”
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->