JITC:天津医科大学肿瘤医院岳东升团队首次揭示,三级淋巴结构或可预测免疫化疗新辅助治疗长期预后
来源:奇点糕 2023-04-24 16:44
最近一年来,免疫检查点抑制剂在非小细胞肺癌(NSCLC)围手术期治疗中可谓是高歌猛进。在新辅助治疗领域,以CheckMate-816研究为代表的免疫化疗方案已经开始改变临床治疗格局,而近期大量的基础研
最近一年来,免疫检查点抑制剂在非小细胞肺癌(NSCLC)围手术期治疗中可谓是高歌猛进。在新辅助治疗领域,以CheckMate-816研究为代表的免疫化疗方案已经开始改变临床治疗格局,而近期大量的基础研究,也揭示了更多免疫新辅助治疗的潜在机制。
不过惊喜之余,还有很多谜题没有解开。比如,免疫化疗新辅助治疗用几个周期更好?免疫化疗新辅助治疗后,哪些生物标志物可以帮助我们更好地预测患者的长期生存?
近期,天津医科大学肿瘤医院岳东升团队在BMJ子刊Journal for ImmunoTherapy of Cancer上发表的一项研究首次发现:新辅助免疫治疗可能会诱导三级淋巴结构(TLS)的形成,同时TLS成熟程度或可作为一种生物标志物,用于预测免疫化疗新辅助治疗后的无病生存期(DFS)【1】。这为免疫新辅助治疗预后评价,提供了一种新的思路。

论文首页截图
人体的免疫系统可谓纷繁复杂。以往的研究显示,TLS的存在与多种癌症更好的预后有关【2】。不同于经典淋巴结构,TLS是在慢性炎症、感染或自身免疫性疾病过程中,在各种组织中形成的异位或非经典淋巴聚集体【3】。
与次级淋巴器官不同,TLS不是身体正常解剖的一部分,而是在局部炎症信号的诱导下发育成熟的。TLS由各种免疫细胞组成,如B细胞、T细胞、树突状细胞等,并分为不同区域。
在这项研究中,岳东升教授团队瞄准了接受免疫化疗新辅助治疗的可切除NSCLC患者,希望探索TLS成熟度和丰度与患者病理反应与长期生存之前的关联。
免疫治疗效果与TLS的关系,也是近年来的探索热点
研究团队回顾性地收集了121例可切除NSCLC患者的FFPE组织标本。根据术前接受治疗的情况,分为三个队列:新辅助免疫化疗组(N=40)、新辅助化疗组(N=41)和未接受治疗组(N=40)。
三个队列之间在年龄、性别、吸烟史、新辅助治疗周期数、N分期、组织学和EGFR突变状态方面没有统计学差异。在新辅助免疫化疗组中,45.0%(N=18)的患者达到主要病理缓解(MPR),其中14例患者为病理完全缓解(pCR);在新辅助化疗组中,只有17.1%(N=7)的患者达到MPR,其中2例为pCR,这和以往免疫化疗新辅助研究中的数据非常类似。
研究通过H&E染色和免疫组化分析,展示了T细胞、B细胞和滤泡树突状细胞(FDCs)的含量,从而识别并定量肿瘤内的TLS。对TLS的评价有两个维度,一是成熟度,分为高成熟度和低成熟度两组;二是丰度,可分为0、1、2、3级。
先看三个队列中TLS的存在情况。在新辅助免疫化疗组中,有34名患者发现了TLS,新辅助化疗组中有21名,而未接受治疗组中有26名。
再看成熟情况。在新辅助免疫化疗组中,40名患者中有30名具有高成熟度TLS。相比之下,新辅助化疗组中仅有13名患者存在高成熟度TLS。在未接受治疗组中,25例显示高成熟度TLS。这提示,免疫检查点抑制剂可能会诱导TLS成熟,而化疗可能会损害TLS的成熟。
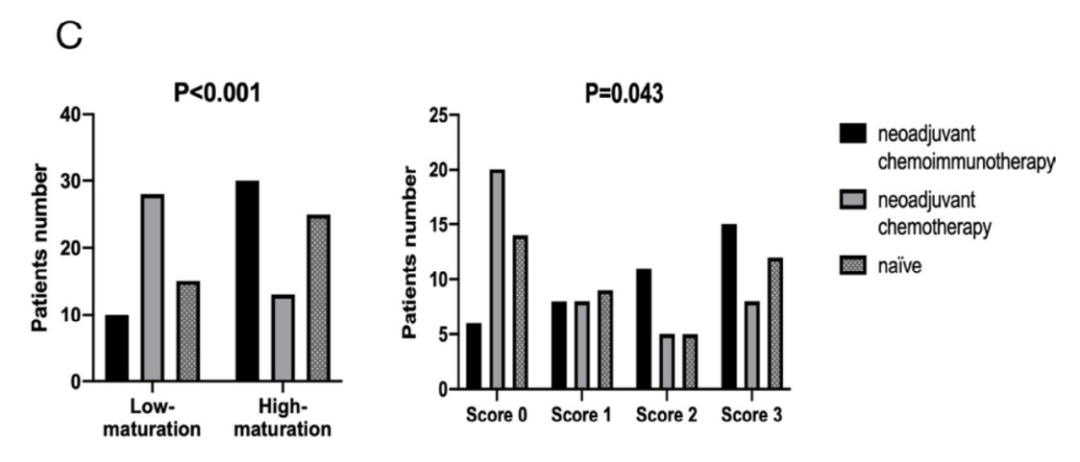
不同组患者中TLS的成熟度差异
最后再来看丰度情况。在新辅助免疫化疗组的40名患者中,分别有6名、8名、11名和15名患者的TLS评分为0、1、2和3级;这一数据在新辅助化疗组中,分别为20名、8名、5名和8名患者;在未治疗组中,分别有14名、9名、5名和12名患者。
可见,新辅助免疫化疗组的TLS在丰度和成熟度两个维度均高于其他两组。接下来再看TLS与新辅助治疗病理反应之间的关系,研究发现,在新辅助免疫化疗组和新辅助化疗组中,MPR患者的TLS成熟程度均高于非MPR患者。
研究团队进一步分析了三个队列中TLS和DFS的关联。中位随访时间24个月后,新辅助免疫化疗组中有12名患者复发或进展,新辅助化疗组和未接受治疗组分别有17名和19名患者复发或进展。
分析显示,三个队列中,TLS高成熟度和高丰度组的DFS均优于低成熟度和低丰度组。多元分析进一步确定,TLS成熟度是新辅助免疫化疗组和未接受治疗组DFS的独立预测因子(新辅助免疫化疗组:P=0.014,HR=4.527,95%CI: 1.351-15.167;未接受治疗组:P=0.035,HR=2.988,95%CI: 1.079-8.276)。
同时,N分期在所有三个队列中都是DFS的独立预测因子(新辅助化疗免疫疗法组: P=0.037, HR=0.259, 95%CI: 0.073-0.923;新辅助化疗组: P=0.003,HR=0.177,95%CI: 0.056-0.558;未接受治疗组: P=0.034,HR=0.341,95%CI: 0.126-0.922)。
使用配对的具有高成熟TLS的治疗前和治疗后肿瘤组织,研究团队进一步分析了在新辅助免疫化疗后达到MPR患者的肿瘤免疫微环境特征。不出所料,治疗后样本的肿瘤基质中CD8+T细胞的密度较高。
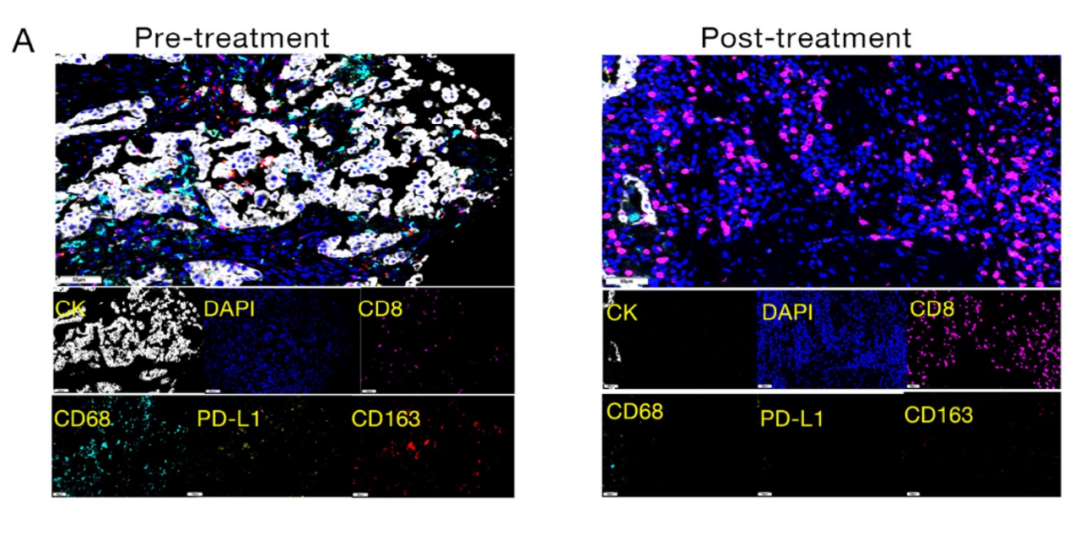
患者治疗前后肿瘤组织的CD8+T细胞密度
总结来看,这项研究提示我们,在NSCLC患者的新辅助治疗中,免疫检查点抑制剂可能会诱导TLS成熟,而化疗可能会损害TLS的成熟;同时,TLS成熟度和免疫化疗新辅助治疗MPR和DFS都正相关。多元分析进一步确定,TLS成熟度是新辅助免疫化疗组和未接受治疗组DFS的独立预测因子。
当然,由于这项研究是单中心小样本回顾性研究,有关TLS在新辅助治疗中的角色还需要有更多的研究去探索。
【1】Sun X, Liu W, Sun L, et al. Maturation and abundance of tertiary lymphoid structures are associated with the efficacy of neoadjuvant chemoimmunotherapy in resectable non-small cell lung cancer. Journal for ImmunoTherapy of Cancer. 2022;10:e005531.
【2】Sautès-Fridman C, Lawand M, Giraldo NA, et al. Tertiary lymphoid structures in cancers: prognostic value, regulation, and manipulation for therapeutic intervention. Frontiers in immunology. 2016;7:407.
【3】Di Caro G, Bergomas F, Grizzi F, et al. Occurrence of tertiary lymphoid tissue is associated with T-cell infiltration and predicts better prognosis in early-stage colorectal cancers. Clinical Cancer Research. 2014;20(8):2147-2158.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


