《科学》:营养对T细胞的影响,实在是太大了!科学家首次发现,糖让T细胞瘫痪,醋是T细胞抗癌力量之源
来源:奇点糕 2025-01-24 09:38
Kaech团队的这项研究成果首次发现,在抗原的长期刺激下,CD8阳性T细胞的营养偏好性对分化和功能的影响,是由ACSS2和ACLY与选择性组蛋白乙酰转移酶的相互作用确定的。
前不久,由美国索尔克生物研究所Susan M. Kaech教授领衔的研究团队,在顶级期刊《科学》发表一篇重磅研究论文。
她们首次发现,杀伤性T细胞对乙酸或葡萄糖的偏好性,可以通过调节T细胞染色体的乙酰化修饰,从而特异性的调控杀伤性T细胞的命运和抗肿瘤能力。
具体来说,在慢性抗原的刺激下,偏好乙酸的T细胞,会分化成抗癌能力较强的功能性T细胞;而偏好葡萄糖的T细胞,则会分化成失去抗癌能力的终末耗竭T细胞。
更重要的是,Kaech团队还发现,抑制T细胞对葡萄糖的偏好,甚至可以逆转终末耗竭T细胞。这一发现,有望改善当前的癌症免疫治疗。索尔克生物研究所的马世鑫博士是论文的第一作者。
Susan M. Kaech是著名的免疫学家、美国国家科学院院士。T细胞代谢、T细胞耗竭和癌症免疫治疗等领域是Kaech团队的研究重点。
她们注意到,在感染或癌症等原因带来的抗原持续刺激,会导致T细胞耗竭,耗竭T细胞有一些标志性特征,例如转录和表观遗传学重编程,以及新陈代谢重新布线等。
Kaech团队想知道,耗竭T细胞的这些特征之间存在怎样的关联。例如,CD8阳性T细胞营养利用的转变,是否有助于在整个分化过程中建立和/或维持不同的表观遗传、转录和功能状态。简单来说,就是T细胞的营养选择,是否会影响T细胞的命运和功能。
她们将乙酰-CoA作为研究突破口,因为它是组蛋白乙酰化的必需底物,可以改变细胞的表观遗传组,进而调节T细胞的转录组和功能。

▲ Susan M. Kaech(左)和马世鑫(图片来源:索尔克生物研究所)
考虑到哺乳动物细胞中,产生乙酰-CoA的酶主要有两个——乙酰-CoA合成酶2(ACSS2,利用乙酸合成乙酰-CoA)和ATP-柠檬酸裂解酶(ACLY,将葡萄糖衍生的柠檬酸转化为乙酰-CoA);因此,她们先研究了不同功能状态T细胞中上述两个酶的水平。
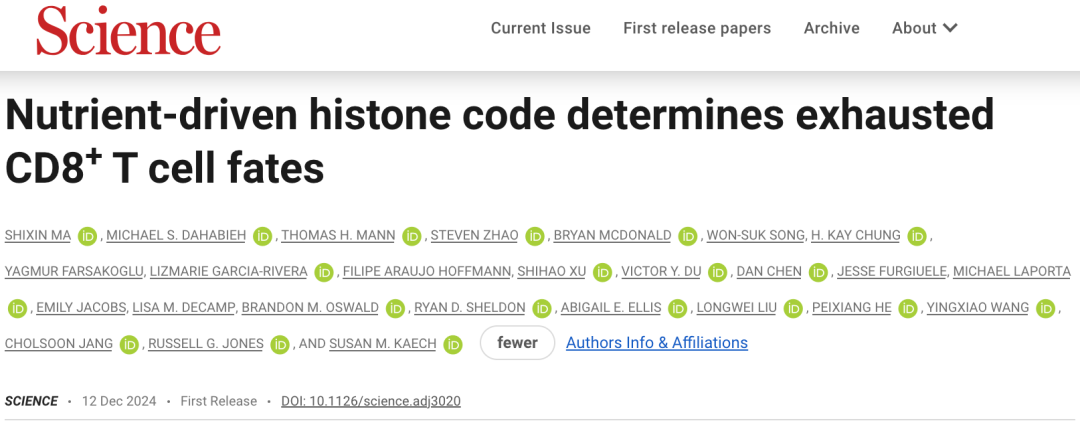
在分析不同肿瘤小鼠模型和人肿瘤组织样本中的肿瘤浸润性CD8阳性T细胞之后,Kaech团队发现,在功能性效应T细胞(TEFF)中,编码ACSS2的基因高表达;而在功能失调的耗竭T细胞(TEX),尤其是终末耗竭T细胞(TEXterm)亚群中,编码ACSS2的基因表达量极低。
文章写到这里,需要补充一个背景信息。耗竭T细胞(TEX)实际上至少有三种状态:祖细胞样TEX(TEXprog),效应样TEX(TEXeff)和终末耗竭T细胞(TEXterm)。其中,TEXprog能够产生功能受限的TEXeff和终末衰竭的TEXterm细胞,也是它在响应免疫治疗。
相较而言,编码ACLY的基因在小鼠和人类肿瘤浸润T细胞的所有状态CD8阳性T细胞中都保持相对稳定;只不过,与功能性TEFF/TEXprog细胞相比,功能障碍的TEX/TEXterm细胞中编码ACLY的基因表达略高。
不难看出,在肿瘤存在的条件下,TEX细胞在维持ACLY表达的同时下调了ACSS2的表达。
▲ 不同功能状态T细胞的Acss2和Acly表达情况
为了进一步研究ACSS2和ACLY这两个乙酰-CoA合成酶的作用,Kaech团队采用基因敲除技术,探索了二者的功能。
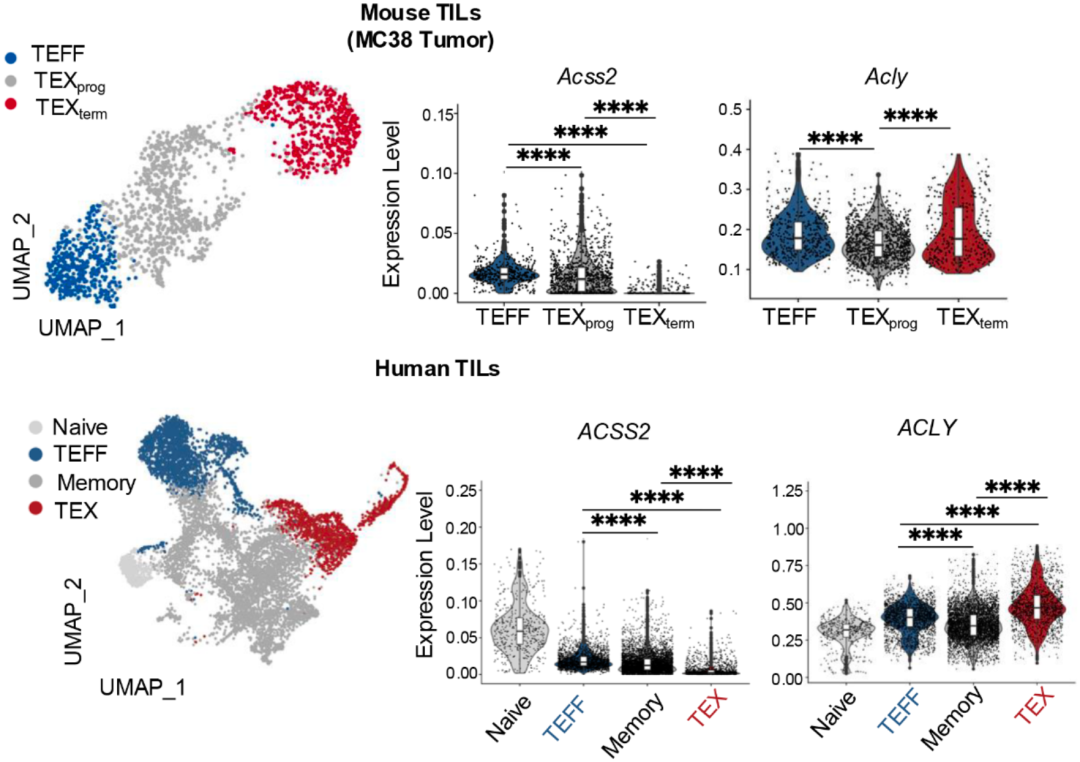
她们发现,在肿瘤存在的情况下,Acss2的缺失会削弱CD8阳性T细胞的活性,更容易分化成终末耗竭T细胞(TEXterm);而Acly的缺失则会增强T细胞的功能,优先分化为祖细胞样TEX(TEXprog)细胞。
值得一提的是,对于CAR-T细胞而言,如果敲除Acly,那么CAR-T就不会进入耗竭状态。由此看来,ACSS2和ACLY对T细胞的命运和功能有极大的影响。
▲ Acss2或Acly缺失的不同影响
接下来,Kaech团队要探索的就是ACSS2和ACLY合成的乙酰-CoA,是否在其中发挥着重要作用。
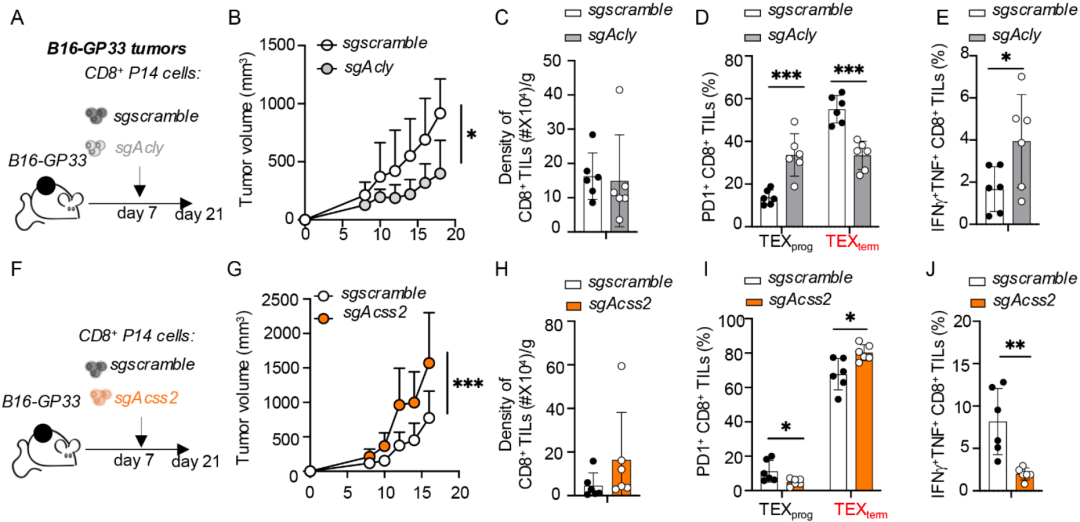
通过给乙酸和葡萄糖做标记,Kaech团队发现,与TEFF细胞相比,TEX细胞利用乙酸衍生乙酰-CoA的产量减少。她们还发现,上述现象这并不是因为乙酸在体内的生物利用率或吸收率降低导致的,而是TEX细胞从本质上限制了细胞核中来自乙酸的乙酰-CoA。
简单来说,TEX细胞表现出更倾向于利用葡萄糖而非乙酸生成细胞核乙酰-CoA。不难看出,ACSS2和ACLY决定了TEFF和TEX细胞对乙酸和葡萄糖的选择性利用。
▲ TEX细胞限制了来自乙酸的乙酰-CoA
从组蛋白的表观遗传组学数据来看,与TEFF细胞相比,TEX细胞中全局H3K27和H3K9组蛋白乙酰化水平(H3K27ac和H3K9ac)有所下降。类似地,与TEXprog相比,TEXterm细胞中H3K27ac和H3K9ac的总丰度较低。Kaech团队认为,这个现象表明葡萄糖不足以维持TEX/TEXterm细胞的核乙酰-CoA水平。
此外,Kaech团队还发现,TEFF细胞的所有组蛋白乙酰化位点上都优先利用了乙酸来源的乙酰-CoA,而TEX细胞则更倾向于将葡萄糖作为其主要来源。在引入基因敲除实验之后,Kaech团队发现,当CD8阳性T细胞从TEFF分化成TEX细胞,或从TEXprog分化成TEXterm细胞时,它们对组蛋白乙酰化的依赖从ACSS2转变为ACLY,即从乙酸转变为葡萄糖。
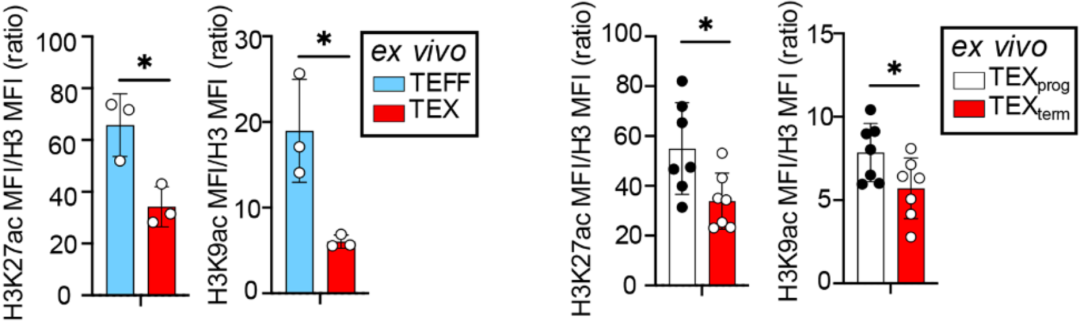
▲ ACSS2和ACLY分别调控TEFF和TEX细胞中乙酸和葡萄糖介导的组蛋白乙酰化
看到此处,我估计大家心中肯定都有个疑问。
无论是ACSS2将乙酸转化成乙酰-CoA,还是ACLY将葡萄糖来源的柠檬酸转化成乙酰-CoA,最后都是乙酰-CoA,为啥染色体的表观遗传学修饰差异这么大呢?
Kaech团队深入揭示了背后的机制。原来与ACSS2和ACLY发生作用的组蛋白乙酰转移酶不同,ACSS2与p300互作调节组蛋白乙酰化,而ACLY与KAT2A互作调节组蛋白乙酰化。
正是这种细胞核内独特的蛋白相互作用,将ACSS2通过乙酸合成的乙酰-CoA,以及ACLY通过葡萄糖源性柠檬酸转化的乙酰-CoA,分别特异性地完成对特定基因位点的组蛋白完成乙酰化,最终特异性地调控与T细胞功能相关蛋白的表达。
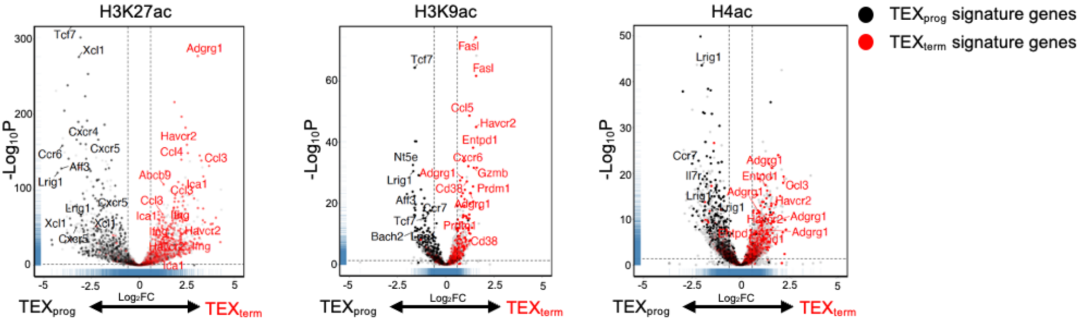
▲ ACSS2(TEXprog)和ACLY(TEXterm)通过乙酰化调节的基因
在研究的最后,Kaech团队探索了这一发现对免疫治疗的影响。
她们发现,在肿瘤小鼠模型中,无论是过表达ACSS2,还是联合PD-L1抑制剂,都会促进TEXprog细胞形成和细胞因子产生增加,以及有效控制肿瘤,并显示出与免疫检查点抑制剂的协同效果。此外,抑制ACSS2则会抑制免疫治疗介导的抗肿瘤免疫反应。
值得注意的是,直接抑制ACLY可显著提高活化CD8阳性T细胞中ACSS2的表达水平,并促进TEXprog细胞的形成。此外,无论是ACLY抑制剂(BMS-303141)单独治疗,还是联合免疫治疗,都会促进肿瘤浸润T细胞的积累。而且ACLY抑制剂治疗也能有效抑制肿瘤生长,并以CD8阳性T细胞依赖的方式,与免疫治疗发挥协同作用。
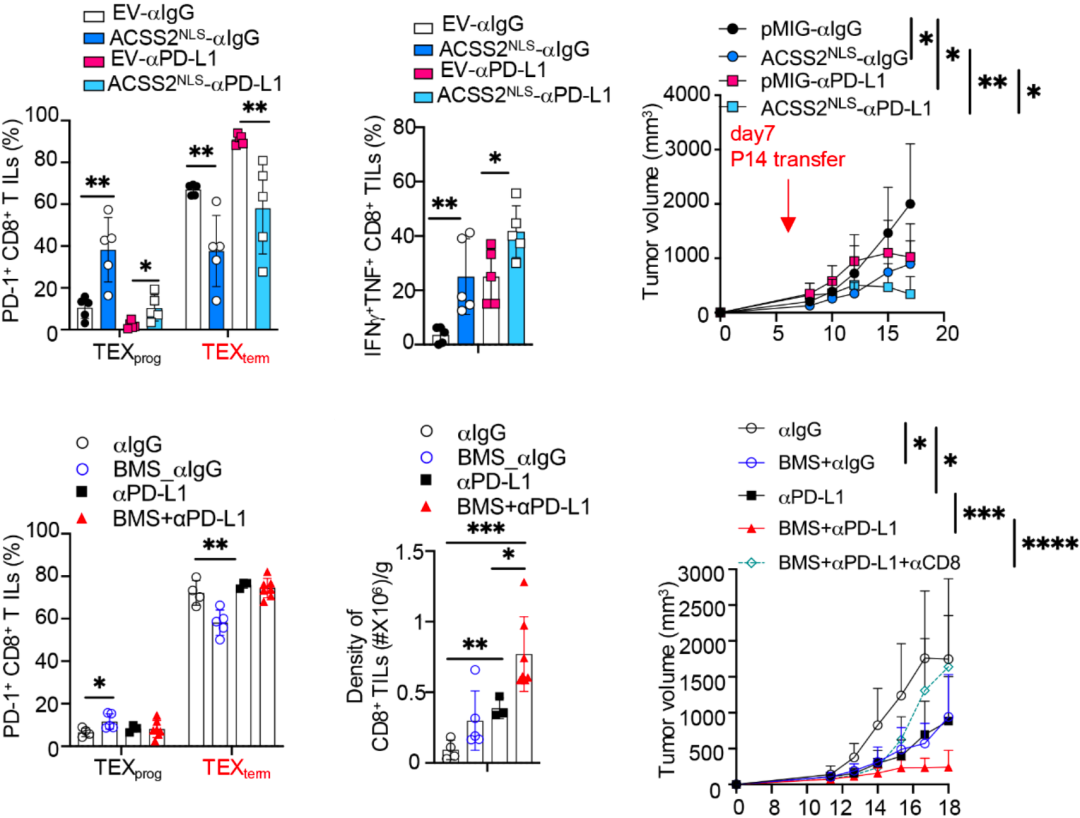
▲ 过表达ACSS2或抑制ACLY,均可以增强免疫治疗效果
总的来说,Kaech团队的这项研究成果首次发现,在抗原的长期刺激下,CD8阳性T细胞的营养偏好性对分化和功能的影响,是由ACSS2和ACLY与选择性组蛋白乙酰转移酶的相互作用确定的。
这一发现让我们对T细胞的抗肿瘤免疫有了新的认知,有助于改善免疫治疗。Kaech团队在讨论部分还指出,在之前的认知中,耗竭性T细胞的表观遗传学状态是不可逆的,但是他们这个研究发现,可以通过操纵核乙酰-CoA代谢,将TEXterm细胞表观遗传重编程为TEXprog细胞,从而优化抗肿瘤T细胞的功能。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


