Nature子刊:中科大占成团队揭示饥饿改善自身免疫疾病的神经机制
来源:生物世界 2024-01-08 10:08
该研究首次发现中枢神经系统在饥饿节食调控免疫中发挥重要作用,被审稿人认为是一个重要的概念性突破,也开辟了摄食神经环路调控免疫系统这一全新研究方向。
中国科学技术大学生命科学与医学部占成团队(王亮为第一作者)在 Nature Neuroscience 期刊发表了题为:Fasting-activated ventrolateral medulla neurons regulate T cell homing and suppress autoimmune disease in mice 的研究论文。
该研究发现,大脑脑干腹外侧延髓核(VLM)中响应饥饿刺激的儿茶酚胺能神经元(简称VLM-CA),能够调节T细胞归巢,并抑制自身免疫疾病。

占成实验室长期研究饥饿感知和摄食调控的神经机制,发现了下丘脑饥饿感知AgRP神经元对维持基础摄食并非不可或缺(Cell Reports 2023),脑干儿茶酚胺能神经元是新的饥饿感知神经,具有很强的促摄食作用(Current Biology 2020,Neuroscience Bulletin 2022),且VLM-CA神经元在介导饥饿等应激刺激,调控血糖水平中发挥重要作用(Neuron 2017)。
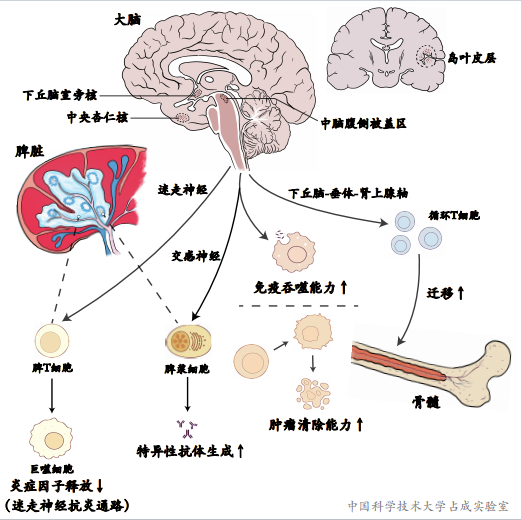
占成实验室近年神经免疫相关进展
在用作多发性硬化症模型的实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)小鼠中,利于化学遗传学直接激活VLM-CA神经元几乎完全阻止了疾病的发生和发展,阻止了动物因病死亡,阻止了大脑炎症和损伤。
为了研究VLM-CA神经元如何控制该自身免疫疾病,占成实验室从细胞机制,神经环路机制,和分子机制上进行了系统性研究。首先,化学遗传学激活VLM-CA神经元减少引流淋巴结中的T细胞的数量。其次,化学遗传学激活VLM-CA神经元减少效应T细胞的数量,而增加naïve T细胞的数量,说明抑制了T细胞活化。再次,化学遗传学激活VLM-CA神经元减少致病免疫细胞在大脑中的浸润,减少脑内IL17, GM-CSF, IFNa等炎症因子水平。
有意思的是,与化学遗传学激活VLM-CA神经元类似,间接性饥饿处理也能减少T细胞数量,抑制T细胞活化,减少大脑中免疫细胞浸润和炎症因子水平。值得注意的是,激活VLM-CA神经元引起的T细胞在大脑中的减少程度远比淋巴结中的减少显著,这提示免疫细胞从外周到中枢的迁移和浸润可能受到了影响。
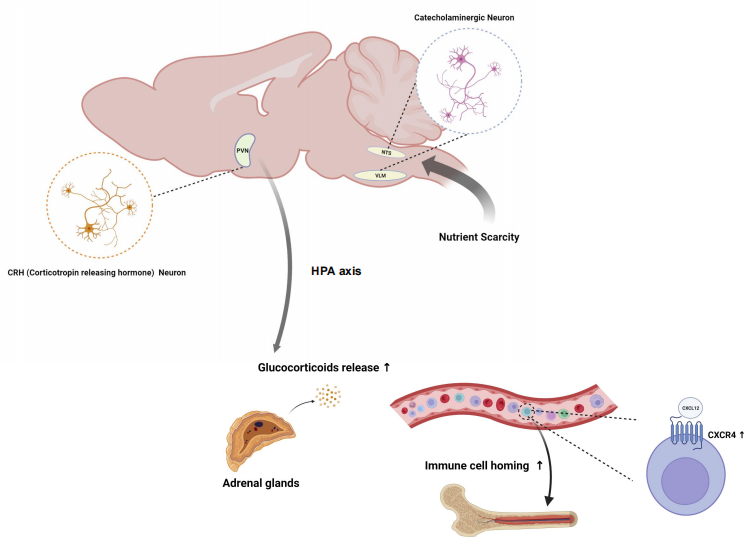
该研究比较了血液、脾脏、骨髓、淋巴结中T细胞分布的变化,发现无论是自身免疫模型小鼠,还是野生型小鼠中的T细胞都在血液、脾脏和淋巴结中减少,但是在骨髓中增加。进一步的研究揭示了一条VLM-CA神经元到下丘脑室旁核CRH神经元的神经环路,该神经环路通过促进糖皮质激素的释放,引起免疫细胞表明趋化因子受体CXCR4的表达上调,最终促使T细胞向骨髓迁移。给与CXCR4的拮抗剂AMD3100不仅阻止饥饿引起的T细胞骨髓迁移,还能够大大抵消VLM-CA神经激活引起的小鼠EAE疾病改善。
这些结果说明VLM-CA神经改善EAE至少部分依赖T细胞向骨髓迁移,减少其大脑浸润。2020年FDA批准了一种治疗多发性硬化的新药西尼莫德(siponimod),该药阻止淋巴细胞从淋巴结逸出,减少外周血淋巴细胞的数量,从而减少大脑的浸润。占成实验室还利于银屑病小鼠模型和超敏延迟反应模型,验证了VLM-CA神经元的免疫抑制作用。
该研究首次发现中枢神经系统在饥饿节食调控免疫中发挥重要作用,被审稿人认为是一个重要的概念性突破,也开辟了摄食神经环路调控免疫系统这一全新研究方向。该研究也首次证明脑干的促食欲神经元具有强烈的抑制自身免疫疾病的作用,并揭示了相应的环路机制,细胞机制,和分子机制,为自身免疫疾病的治疗提供了新靶点和新思路。另外,近年来神经调控免疫,神经调控外周是国际前沿研究,该项研究再次说明,神经系统在调控包括免疫系统的外周组织和器官中发挥重要的作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


