Cell Discovery:复旦大学詹成/范虹等提出基于铁死亡的肺癌治疗新策略
来源:生物世界 2025-10-09 10:42
这项研究表明,SUMO2-K11la 是肺腺癌对铁死亡抵抗的关键调控因子,并提示了通过细胞穿透肽靶向 SUMO2-K11la 可能是一种增强基于铁死亡的癌症治疗策略的有前景的新方法。
肺癌是一种极为常见的恶性肿瘤,是全球癌症相关死亡的主要原因。值得注意的是,非小细胞肺癌(NSCLC)约占所有肺癌病例的 85%,其中肺腺癌(LUAD)是最常见的亚型。尽管癌症治疗方面近来有所进展,但肺腺癌患者的预后仍然不佳,五年生存率低于 26%。
乳酸化修饰(lactylation)是一种由乳酸(LA)介导的蛋白质翻译后修饰,因其在表观遗传调控中的关键作用而备受关注。然而,乳酸化修饰与铁死亡在肺腺癌(LUAD)中的复杂相互作用,仍有待全面阐明。
2025 年 10 月 7 日,复旦大学附属中山医院詹成、范虹、Bi Guoshu 等人在 Cell Discovery 期刊发表了题为:Ferroptosis-induced SUMO2 lactylation counteracts ferroptosis by enhancing ACSL4 degradation in lung adenocarcinoma 的研究论文。
该研究表明,铁死亡诱导的 SUMO2 乳酸化修饰,通过增强肺腺癌中 ACSL4 的降解来对抗铁死亡,揭示了肺腺癌抵抗铁死亡的关键调控因子,进而提出了基于铁死亡的癌症治疗新策略。

铁死亡(Ferroptosis)是一种受调控的细胞死亡形式,其特征在于活性氧(ROS)的生成、脂质过氧化物的积累、细胞内二价铁(Fe2+)水平的升高以及抗氧化途径的抑制。诱导铁死亡的策略在克服传统癌症治疗手段(包括化疗、放疗和免疫治疗)的耐药性方面已展现出显著效果。越来越多的证据表明,铁死亡与众多细胞代谢过程有关,尤其是线粒体代谢(因为线粒体是活性氧的主要生成场所)。鉴于线粒体损伤是铁死亡的特征,细胞在铁死亡期间更依赖糖酵解来获取能量,从而导致乳酸(LA)的积累增加。尽管先前的研究表明乳酸通过调控脂质代谢和抗氧化系统来抑制铁死亡,但乳酸活性的另一面——乳酸化修饰(lactylation),在铁死亡中的意义仍需进一步阐明。
在这项最新研究中,研究团队通过代谢组学分析和全面的代谢库筛查,发现铁死亡显著增加乳酸积累以及随后的蛋白质乳酸化修饰,这反过来又使肺腺癌细胞对铁死亡产生抗性。
进一步功能检测表明,SUMO2-K11 乳酸化修饰(SUMO2-K11la)作为对铁死亡诱导反应中乳酸化水平显著升高的关键因素,是决定铁死亡抗性的关键所在。Sumoylation 修饰蛋白质组学和免疫共沉淀实验表明,SUMO2-K11la 会削弱 SUMO2 与 ACSL4 之间的相互作用。因此,这种干扰促进了 ACSL4 的降解,从而扰乱了脂质代谢,并有效地抑制了铁死亡。
此外,AARS1 被确认为 SUMO2-K11la 的乳酸化转移酶,而 HDAC1 则是其去乳酸化酶。基于这些发现,研究团队开发了一种细胞穿透肽,它能竞争性且特异性地抑制 SUMO2-K11la。这种细胞穿透肽肽在异种移植小鼠模型中显著增强了铁死亡并使肺腺癌对化疗药物顺铂敏感,同时在自发性肺癌模型中增强了化疗免疫治疗响应。
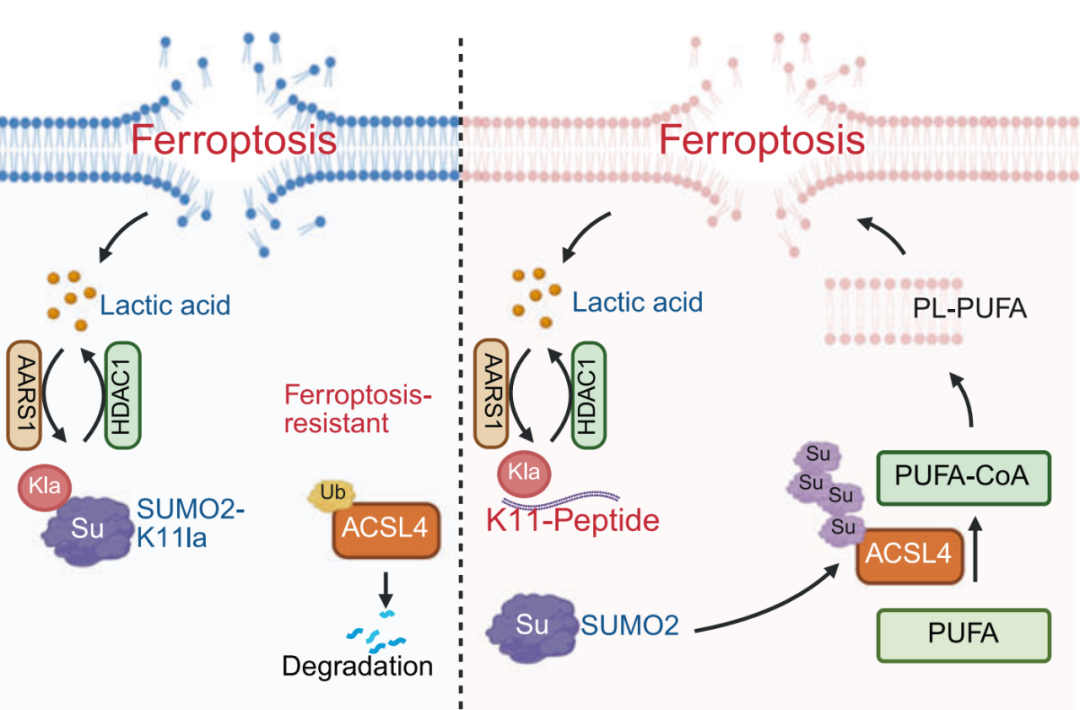
总的来说,这项研究表明,SUMO2-K11la 是肺腺癌对铁死亡抵抗的关键调控因子,并提示了通过细胞穿透肽靶向 SUMO2-K11la 可能是一种增强基于铁死亡的癌症治疗策略的有前景的新方法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


