看完这篇Cell系列综述,你就能理解自身免疫疾病与癌症免疫疗法的下一个风口
来源:生物世界 2025-11-20 14:11
ADAR1 的故事是一个完美例证,展示了基础生物学研究如何揭示生命的基本规律,并最终为重大疾病的治疗带来革命性突破。
在我们身体的每个细胞里,时刻都在进行着一场静默的“暗战”——细胞中的 RNA,有时会形成一些类似病毒 RNA 的双链 RNA(dsRNA)结构,如果它们被免疫系统误判为“外敌入侵”,就会引发可怕的自身免疫风暴。防止这场灾难发生的关键,是一个名为 ADAR1 的蛋白质。
然而,ADAR1 有着两面性,它不只是发挥着维持体内免疫平衡以防止自身免疫疾病的作用,还发挥着促进癌症进展、免疫逃逸和治疗耐药性的作用。
近日,Cell Press 旗下综述期刊 Trends in Cell Biology 发表了来自牛津大学的题为:ADAR1: from basic mechanisms to inhibitors 的综述论文,该综述系统梳理了 ADAR1 的最新研究进展,解读了其两面性——ADAR1 的缺失会导致自身免疫疾病,而其表达会促进癌症的发展和转移,该综述还探讨了 ADAR1 对人类疾病的意义——开发 ADAR1 抑制剂用于癌症治疗。

ADAR1:细胞的“自我标识”工程师
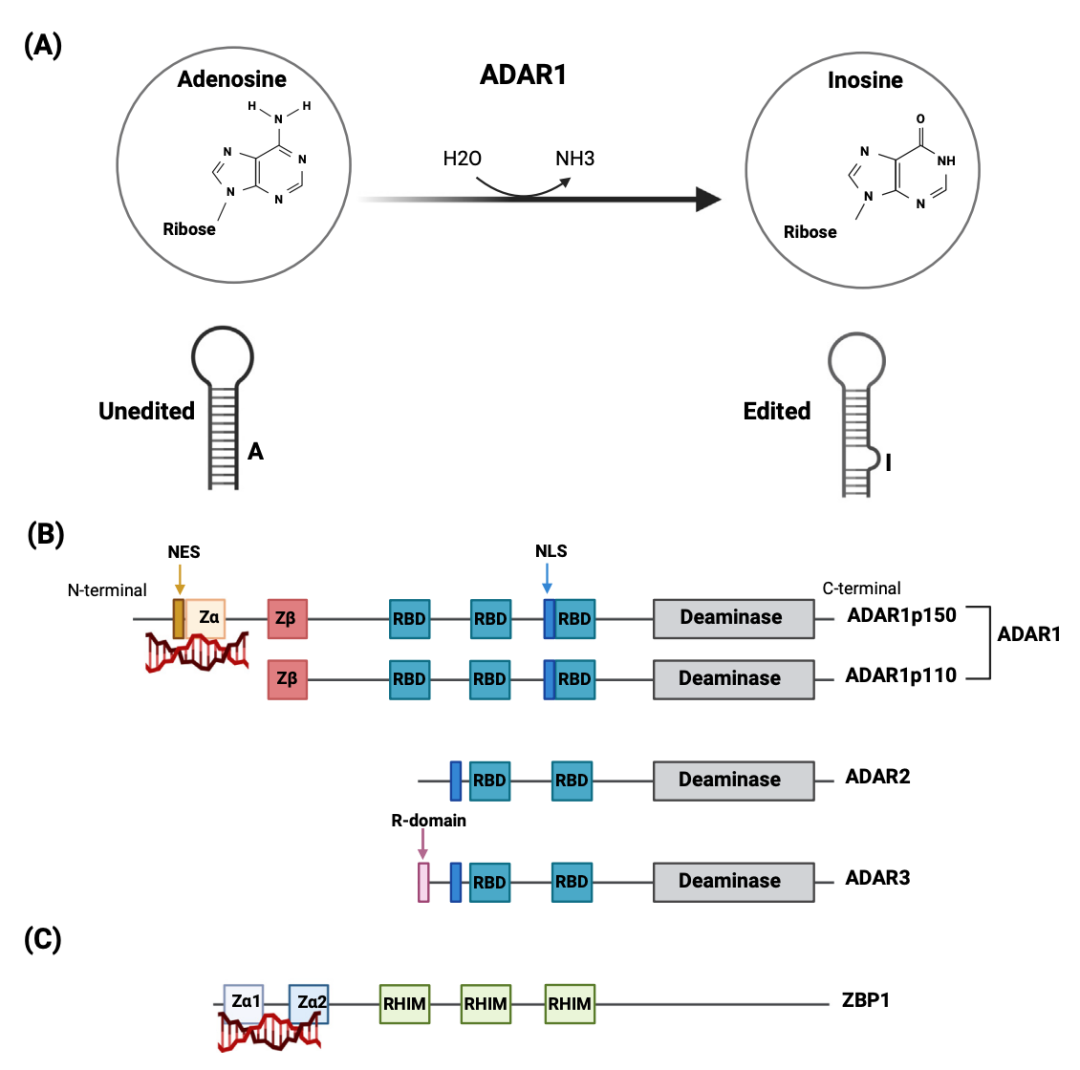
ADAR1 的核心功能是“RNA 编辑”。作为一种 RNA 编辑酶,它能在双链 RNA(dsRNA)分子中将腺苷(A) 转化为肌苷(I),这个过程被称为 A-to-I 编辑。而肌苷(I)在细胞中被“读作”鸟苷(G)。因此,A-to-I 编辑会被识别为 A-to G,从而实现 RNA 水平的基因编辑。更重要的是,A-to-I 编辑会改变双链 RNA 结构,使其变得“不规则”。这种结构上的改变,相当于给自身 RNA 打上了一个“友军”标识,从而避免被自身免疫系统误伤。
ADAR1 主要有两个亚型——ADAR1p110:长期驻扎在细胞核内,主要负责基础性的 RNA 编辑,与细胞发育和稳态维持相关;ADAR1p150:受干扰素诱导产生,是一个“明星角色”,它拥有独特的结构,能穿梭于细胞核和细胞质之间,特别是其 Za 结构域能识别一种不寻常的 Z 型 RNA。ADAR1p150 是抑制免疫系统过度激活的关键防线。
一旦失守:ADAR1 缺陷与自身免疫风暴
如果 ADAR1(尤其是 p150 亚型)功能失常,后果是灾难性的。研究表明,无论是人类还是小鼠,细胞中 ADAR1 的缺失或突变,都会导致严重的自身炎症疾病。
当 ADAR1 缺失时,那些未经编辑的“原生”内源性 dsRNA 就会暴露出来,激活细胞内的多个“警报器”——dsRNA 传感器:
1、MDA5:如同哨兵,会识别长长的、完美的 dsRNA。一旦被激活,就通过 MAVS 蛋白信号通路启动干扰素表达,拉起全身警报;
2、PKR:被激活后会磷酸化 eIF2α 蛋白,按下全球蛋白质合成的“暂停键”,启动整合应激反应,最终可能导致细胞死亡;
3、ZBP1:一个特别有趣的传感器,它能识别不寻常的 Z-RNA。ADAR1p150 的 Za 结构域同样能结合 Z-RNA,从而与 ZBP1 相竞争,抑制其激活。ZBP1 被激活后会引发细胞程序性死亡和炎症。
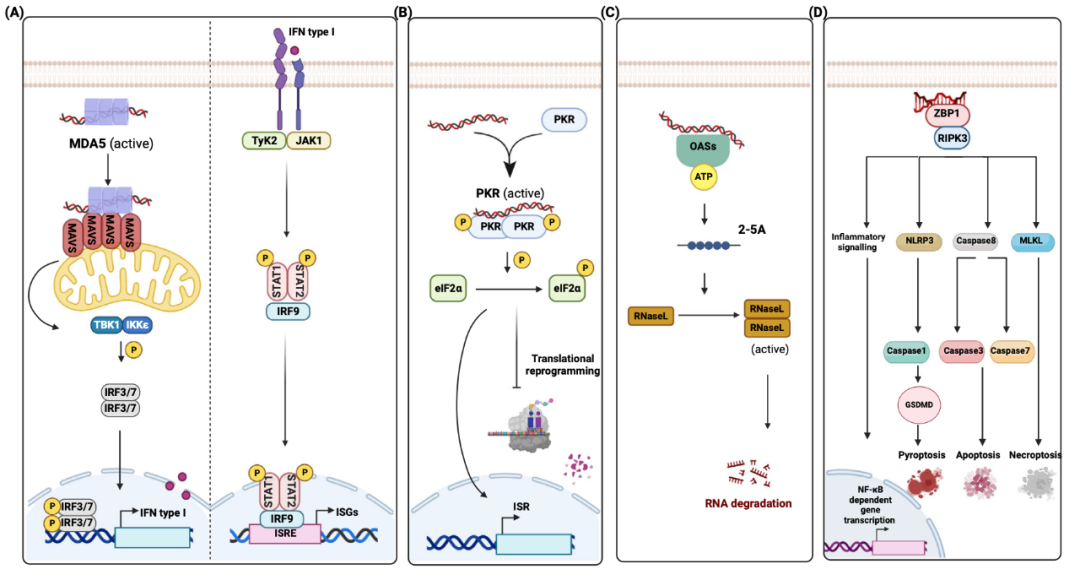
在人类中,ADAR1 缺失会表现为 Aicardi-Goutières 综合征(AGS) 等严重脑病,患者体内会持续产生干扰素,如同一直处于病毒感染状态。在小鼠中,完全敲除 ADAR1 则会直接胚胎致死。
攻守转换:ADAR1 在癌症中的“双面角色”
有趣的是,这个维持生命免疫系统稳态的“守护神”,却可能被癌细胞“策反”。
在某些癌症中,ADAR1 扮演了“帮凶” 的角色。癌细胞基因组不稳定,会产生大量内源性 dsRNA。为了不被免疫系统清除,癌细胞会上调 ADAR1 的表达,利用其功能来“伪装”自己,从而逃避免疫监视。
这也为癌症治疗提供了一个绝妙思路——如果抑制了 ADAR1 的功能,不就等于撕掉了癌细胞的“伪装”,让免疫系统能够识别并攻击它们了吗?
这正是当前癌症免疫治疗领域最令人兴奋的方向之一——“病毒模拟” 。通过抑制 ADAR1,让癌细胞积累大量未编辑的 dsRNA,模拟病毒感染的状态,激活体内的天然免疫和适应性免疫反应,从而杀伤肿瘤。
已有多项研究表明,ADAR1 抑制剂与免疫检查点阻断疗法(例如抗 PD-1 单抗) 或表观遗传药物(例如 DNMT 抑制剂) 联用,能产生显著的协同效应,极大地增强抗癌效果。
未来可期:ADAR1 抑制剂的研发策略
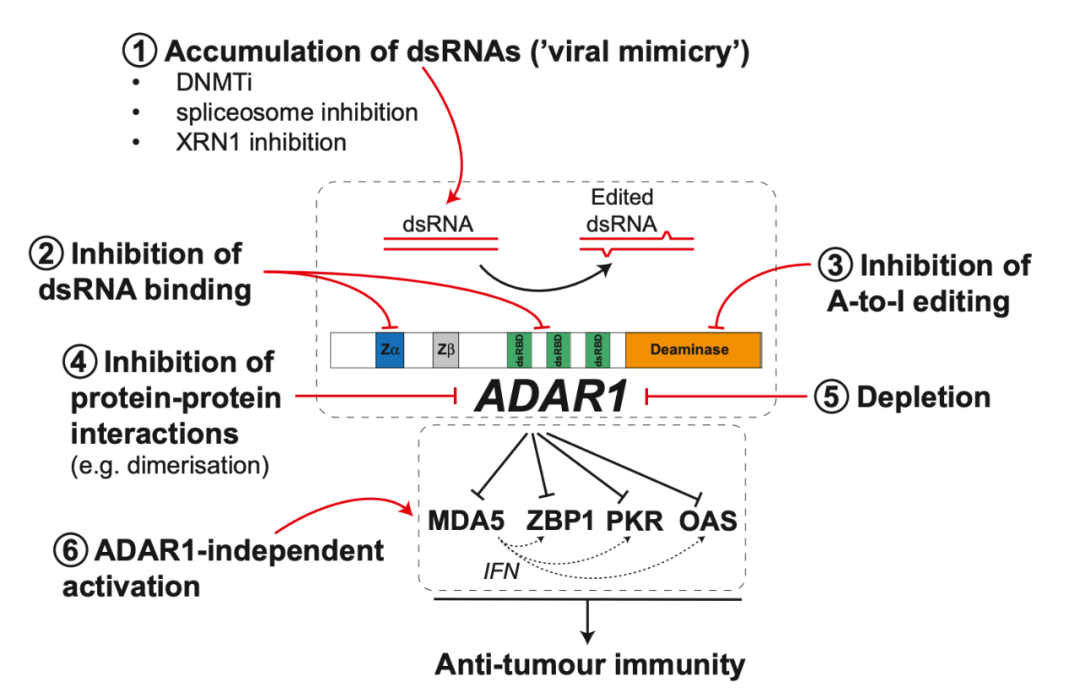
基于如此明朗的应用前景,开发 ADAR1 抑制剂已成为新的热点。该综述介绍了通过 6 种不同的策略来抑制 ADAR1 的促肿瘤作用——
1、积累 dsRNA:使用 DNA 甲基转移酶抑制剂(DNMTi)、剪接体抑制剂或 XRN1 抑制剂,会提高内源性免疫原性 dsRNA 水平,这可能会使 ADAR1 的 RNA 编辑能力饱和,从而使免疫系统感知 dsRNA;
2、抑制 ADAR1 与 dsRNA 的结合;
3、抑制 ADAR1 的脱氨酶活性;
4、抑制 ADAR1 与下游传感器的蛋白-蛋白相互作用。这三种方法均可能导致未编辑的 dsRNA 积累,从而可供免疫系统感知;
5、耗竭 ADAR1,通过 PROTAC 降解 ADAR1 蛋白,或调控 ADAR1 前体 mRNA 的加工以特异性降低 ADAR1p150 亚型的表达,同样可实现未编辑的 dsRNA 积累;
6、“绕道”激活,直接激活 ZBP1 等 ADAR1 的下游传感器,模拟 ADAR1 被抑制后的效果。
总结与展望
ADAR1 的故事是一个完美例证,展示了基础生物学研究如何揭示生命的基本规律,并最终为重大疾病的治疗带来革命性突破。从防止自身免疫到抗击癌症,ADAR1 领域的研究正在飞速发展。
未来,研究人员仍需解答几个关键问题——
究竟是哪些特定的内源性 dsRNA 最易引发自身免疫?
在抑制 ADAR1 时,如何平衡疗效与潜在的自身免疫风险?
能否开发出只靶向癌细胞内 ADAR1p150 亚型的高选择性抑制剂?
ADAR(Adenosine deaminases acting on RNA)家族,是催化 RNA A-to-I 编辑的关键酶类,其在调控 RNA 多样性,以及维持免疫稳态及神经系统功能中发挥着核心作用。近年来,基于 ADAR 的 RNA 编辑技术得到了快速发展,相比基于 CISRPR 基因编辑技术,其无需引入外源编辑酶或效应蛋白,避免了递送难题以及相关免疫原性等问题,此外,其不会改变 DNA 改变,更具安全性。在遗传疾病治疗中潜力巨大,正被开发为新一代基因编辑疗法。
此外,还有多项研究表明,ADAR1 不仅是 RNA 编辑酶,还与自身免疫疾病、癌症等疾病密切相关,已成为重要的疾病治疗新靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


