Cell子刊封面:许琛琦/施小山/王皞鹏合作揭示TCR信号多样性的脂质静电调控机制
来源:生物世界 2025-10-06 14:35
该研究利用核磁共振、定量质谱和细胞实验,解析了 TCR-CD3 复合物中关键信号亚基 CD3ζ 的胞内区结构以及磷酸化规律,揭示了正电基序与脂质相互作用在其中的关键调控机制。
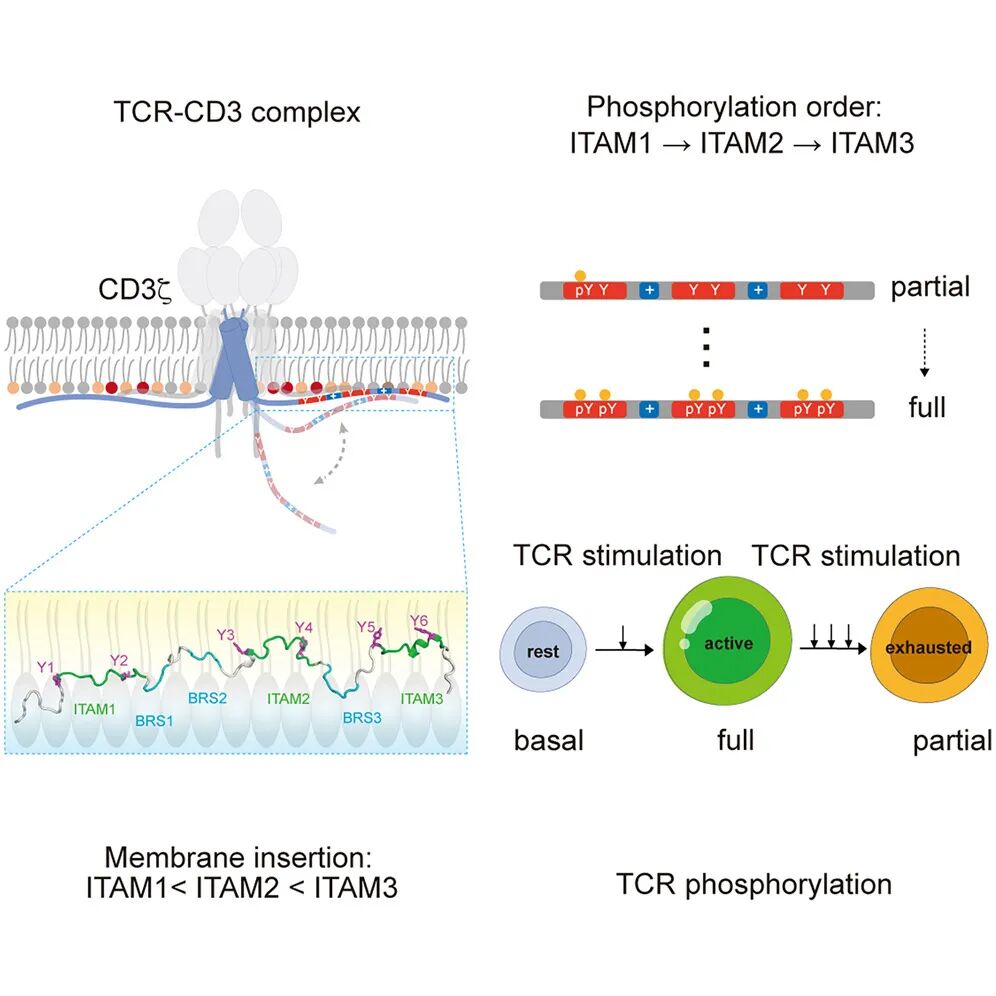
作为抗原受体,T 细胞受体(TCR)-CD3 复合物在 CD3 亚基中包含一组免疫受体酪氨酸活化基序(Immunoreceptor activation tyrosine-based motif,ITAM),以转导多种抗原信号,但 TCR 信号多样性的潜在机制仍不清楚。
该研究利用核磁共振、定量质谱和细胞实验,解析了 TCR-CD3 复合物中关键信号亚基 CD3ζ 的胞内区结构以及磷酸化规律,揭示了正电基序(Basic residue Rich Sequence,BRS)与脂质相互作用在其中的关键调控机制,同时提出了 CD3ζ 磷酸化不充分是 T 细胞功能耗竭的诱因之一,为合成免疫受体的理性设计提供了新思路。


封面图:六孔长笛象征着 TCR 复合物的关键信号亚基 CD3ζ,其含有六个酪氨酸磷酸化位点。正如覆盖或揭开不同的孔会产生不同的声音一样,不同酪氨酸的磷酸化和去磷酸化会产生不同的信号输出。该研究描述了 CD3ζ 细胞质尾部的核磁共振结构和磷酸化动力学,突出了构象动力学如何支撑 TCR 信号转导的功能多样性。该封面图由许琛琦课题组的张雨萌绘制。
在这项最新研究中,研究团队揭示了 TCR-CD3 复合物中关键信号亚基 CD3ζ 的结构和功能异质性。利用核磁共振光谱技术,对动态 CD3ζ 细胞质结构域的膜结合结构进行了表征。ITAM1、ITAM2、ITAM13 显示出膜插入的逐渐增加,导致从 N 端到 C 端的连续磷酸化顺序,并在生理触发下生成部分磷酸化和完全磷酸化。
在慢性 TCR 刺激的情况下(这种情况与癌症和慢性感染相关),C 端 ITAM 的磷酸化衰减速度比 N 端 ITAM 快,导致 TCR 信号传导不足。因此,这项研究揭示了 TCR 信号转导中 ITAM 异质性的一种新机制,这与生理和病理环境相关。
该研究的核心发现:
CD3ζ 结构显示,从 N 端到 C 端,ITAM 的膜插入程度逐渐增加;
在生理刺激下,磷酸化从 ITAM1 进行到 ITAM3;
CD3ζ BRS 突变消除了 ITAM 磷酸化层级;
慢性 TCR 刺激诱导部分 CD3ζ ITAM 磷酸化。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


