《癌细胞》:中国科学家揭示食管癌前病变走向癌变的关键基因组改变!
来源:奇点糕 2023-12-08 10:06
先提个简单的问题:正常细胞演变成癌细胞的原因是什么?
先提个简单的问题:正常细胞演变成癌细胞的原因是什么?
答案当然是基因突变,但即使是TP53这样关键的抑癌基因发生突变,也不会总是导致细胞癌变。2019年发表在《自然》的一项研究就对人体食管组织进行了“摸底”,发现正常老年人食管上皮细胞中,近八成存在TP53突变或可能驱动癌症发生的NOTCH1基因突变,但绝大多数细胞还维持在正常状态[1]。
换句话说,哪怕这些已有关键基因突变的细胞就像癌变的“火药桶”,也需要有个火星或者引信来点燃它们,那么引燃物又是什么呢?近期我国学者发表在Cancer Cell期刊上的一项最新研究,或许就能揭示答案!
中国医学科学院肿瘤医院林东昕、吴晨课题组,华中科技大学公共卫生学院常江课题组和北京大学生物医学前沿创新中心白凡课题组通力合作,对食管鳞状细胞癌(ESCC)癌前病变展开研究,并比对正常食管和ESCC,揭示癌前病变早期出现的TP53基因双等位缺失,可介导此后多个癌症关键基因的拷贝数变异(CNAs)及表达失调,并最终导致癌变发生[2]。
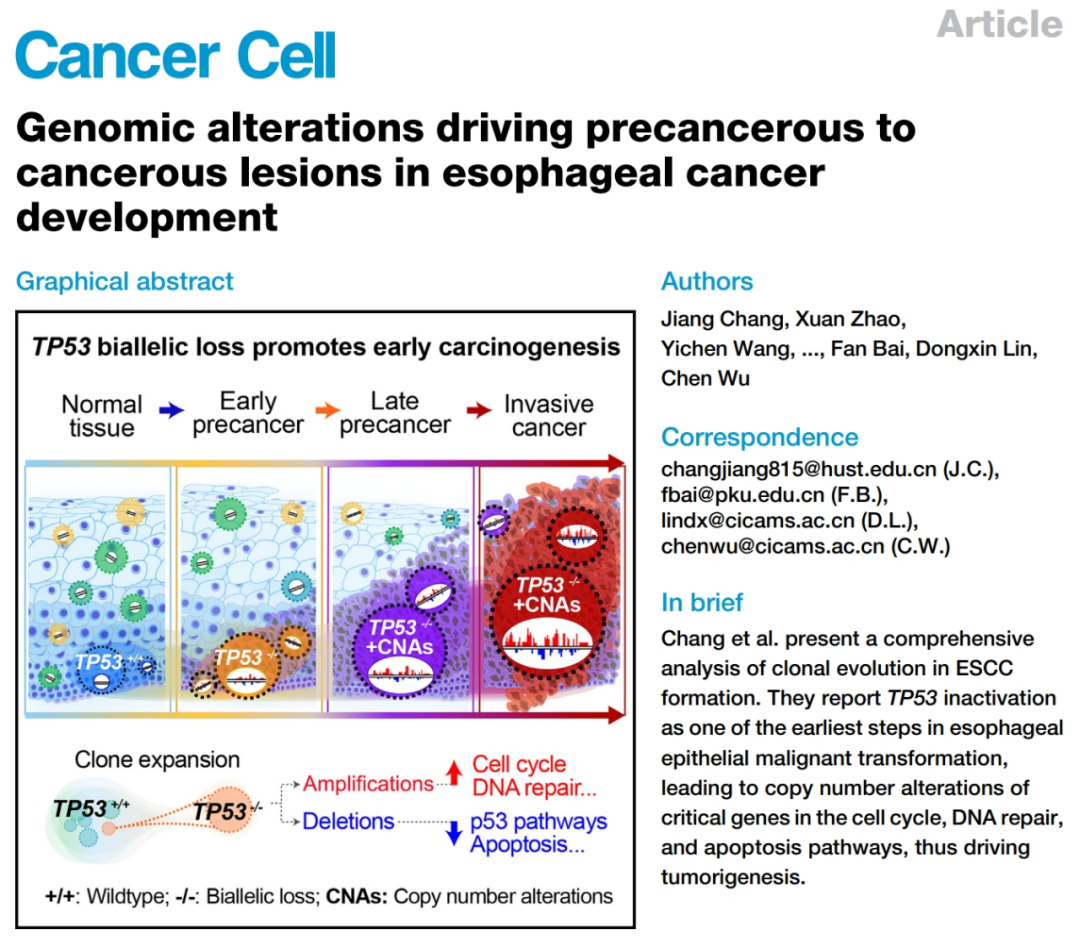
一图总结论文核心内容
食管癌是我国高发的消化系统癌症之一,发病总数和致死数都占全球接近一半的水平,而我国食管癌在组织学类型上大多属于ESCC。从癌症发生发展的过程来看,食管癌经历了多个阶段的演进,即从正常组织到癌前病变再到最终的癌症“大魔王”,癌变过程很有代表性,但这一过程中的相应基因组改变仍不十分明确,所以既往科学界还没找到基因层面的“引燃物”。
针对这个尚未解开的谜题,我国学者们基于在国内食管癌高发区——河南林州建立的ESCC筛查及研究队列开展了本次研究,共从28例正常健康人和不同食管癌前病变阶段的人群中(共42份活检样本),以激光显微切割技术获取了1275个微小样本,再按照食管细胞癌变的时间顺序,在各个不同阶段开展基因组层面的研究,分析动态演变过程和其中的关键事件。
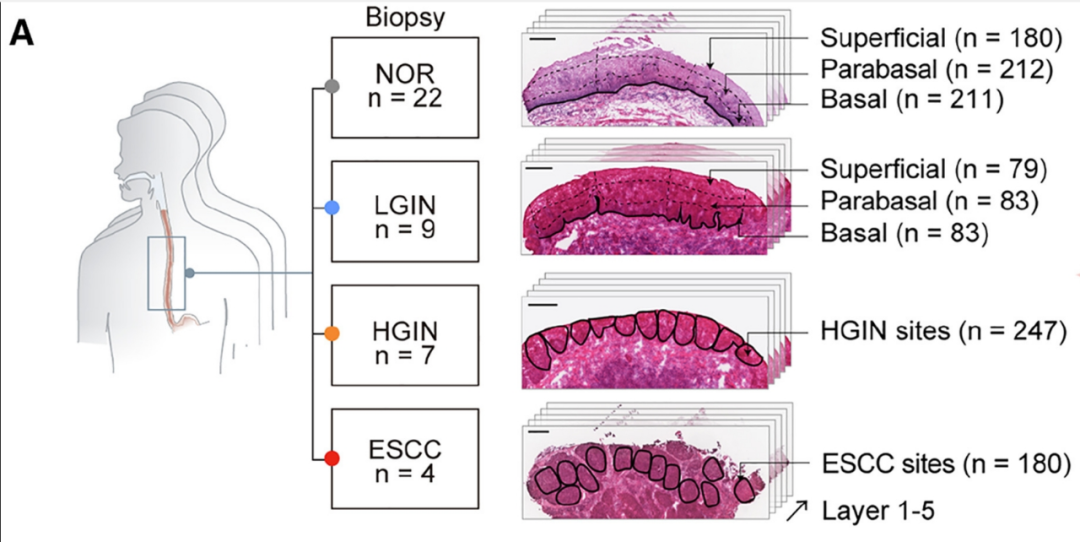
研究方法汇总,即纳入的不同食管癌前病变阶段及微小样本来源分布
研究者们首先分析了27个ESCC相关基因[3]的突变频率及分布,发现在研究样本中存在18个基因的突变,突变频率最高的基因仍是TP53和NOTCH1,但它们的突变频率变化趋势却恰好相反:随着癌前病变程度不断加重,TP53的突变频率会一路飙升,而NOTCH1却与此恰好相反,其突变在较早期的癌前病变(如低级别上皮内瘤变/LGIN)中更多见。
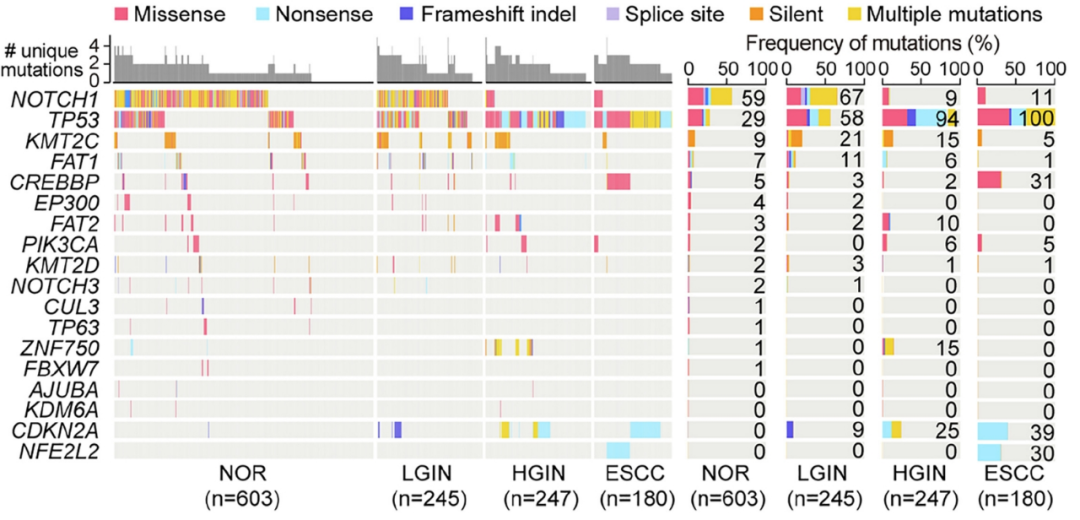
癌前病变不同阶段的ESCC相关基因突变频率
而关键基因的拷贝数变异(CNAs)早在LGIN阶段就能够出现,但变化趋势是与TP53突变频率一致的,即癌前病变程度越重、CNAs就越多见。而大量研究都显示,TP53发生突变特别是功能缺失性突变,会直接导致细胞基因组的整体不稳定,研究者们开展的统计学分析也证实,ESCC相关基因中仅有TP53的突变与CNAs水平呈显著正相关性。
基于上述分析结果,研究者们重建了ESCC癌变过程进化树,证实随着癌前病变不断加重,病变组织中的癌克隆会从以NOTCH1突变克隆为主,逐渐转变为TP53突变克隆占主导,基因突变负荷和CNAs也相应不断上升,且CNAs往往与TP53基因双等位缺失同时出现;相比TP53单个等位基因突变,双等位缺失克隆的CNAs水平更高,更可能介导癌症发生。
接下来,研究者们分析了单细胞测序和空间转录组学数据,并借助CRISPR基因功能筛选实验证实,TP53双等位缺失克隆能够具有竞争优势,逐渐占据主导地位,是因为这类克隆中的细胞周期(如转录因子E2F靶基因CKS1B、TOP2A等)和DNA损伤修复通路(如FEN1、PRPF19等)基因表达水平显著上调,且TP53和凋亡相关通路基因表达显著下调,这会导致食管上皮细胞的增殖能力大幅增强,伴随基因组不稳定性,最终使细胞走上癌变的不归路。
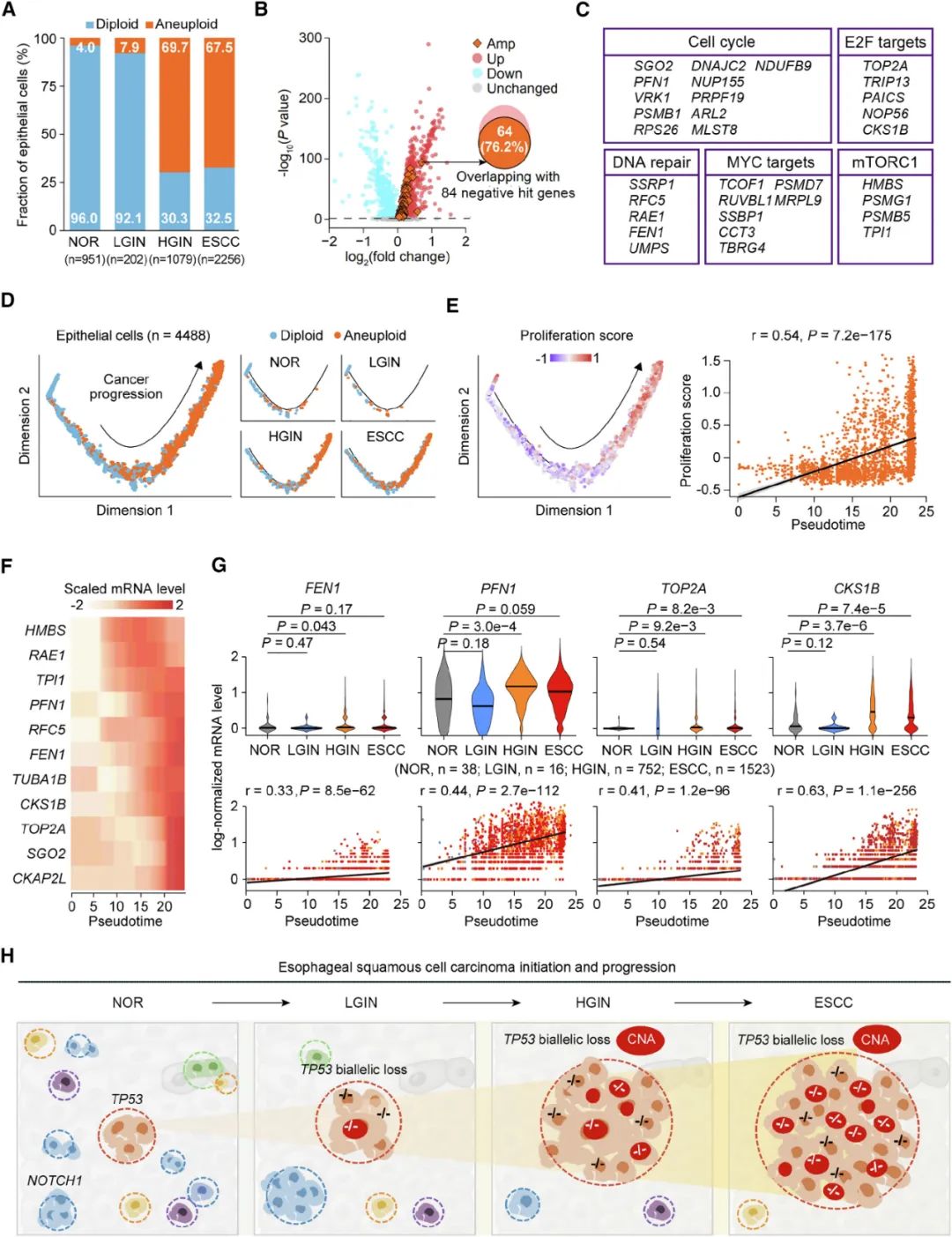
单细胞RNA测序揭示TP53基因双等位缺失,最终导致ESCC发生的可能机制
总而言之,本次研究对ESCC发生发展过程中的基因组时空动态变化进行了全方位解码,并找到了可能有临床价值的早期癌症分子标志物和干预靶点,期待这些发现能够为食管癌的精准早期干预提供指引,帮患者赢取更多生机
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


