《神经元》:厦大团队开发鼻腔给药tau蛋白抗体,可有效改善小鼠阿尔茨海默病病理
来源:奇点糕 2024-04-29 09:10
该研究发现,以p-tau 217为靶点的被动免疫治疗是一种改善AD神经退行性病变的有效手段。
近期,厦门大学神经科学研究所赵颖俊团队发表了一项重要研究成果,他们开发了一种特异性靶向p-tau 217的单克隆抗体—mAb2A7。
通过鼻腔给药的方式将mAb2A7成功递送到雄性tau病理小鼠(PS19)的大脑后,研究团队发现,mAb2A7治疗不仅可以改善小鼠的tau病理,还能抑制其导致的神经元死亡和脑萎缩,逆转了小鼠的认知障碍,改善了小鼠的运动功能,恢复了小鼠大脑的蛋白稳态。
研究发表在《神经元》上。

论文首页截图
tau蛋白是一种高度可溶的微管相关蛋白,主要在神经元中表达。正常情况下,健康的tau蛋白会结合在微管上,用于稳定微管的结构。但在病理情况下,比如在磷酸酶的作用下,tau蛋白出现过度磷酸化,从微管上脱落,聚集形成了神经纤维缠结,疾病就这样发生了。
因此,特异性靶向磷酸化的tau蛋白可能是治疗tau病理相关疾病的有效手段。既往研究显示,在AD的早期阶段,患者的脑脊液和血浆中会出现p-tau 217水平升高的现象,此外,与p-tau 181相比,脑脊液中p-tau 217水平与AD患者脑内tau沉积的关系更为密切。
因此,赵颖俊团队打算从p-tau 217入手,试图开发出针对p-tau 217的tau蛋白抗体疗法。
有了想法后,研究团队筛选出了一种可以和人类p-tau 217特异性结合,且具有高亲和力的抗体mAb2A7。通过使用mAb2A7进行超灵敏单分子检测量化AD患者脑脊液和血液中的p-tau 217水平后,研究团队发现,与非痴呆对照组相比,AD患者脑脊液和血液中p-tau 217水平显著升高。
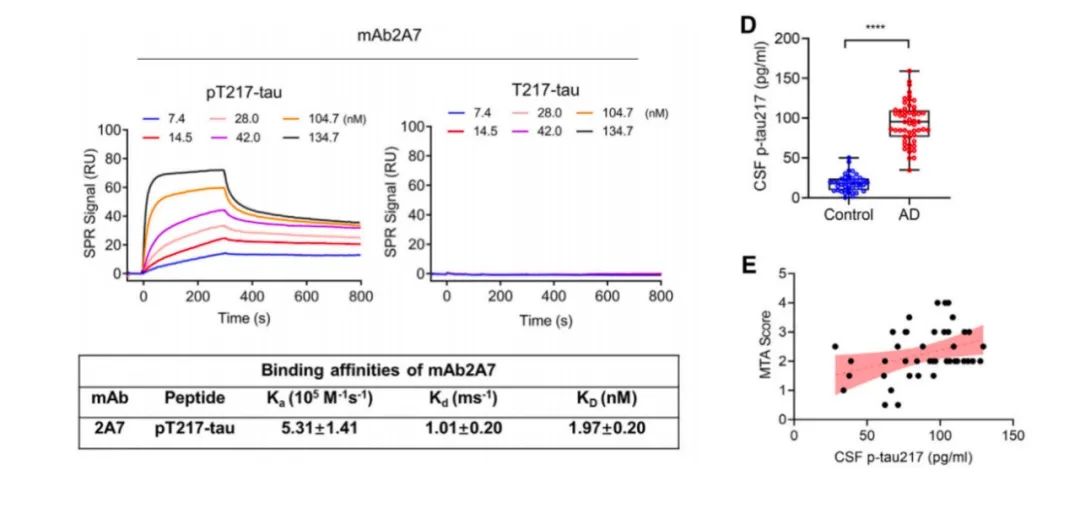
进一步分析显示,AD患者脑脊液中的p-tau 217水平与海马萎缩(内侧颞叶萎缩量表MTA评分)和认知损伤(精神状态检查量表MMSE评分)成正相关。
以上研究结果表明,p-tau 217水平与AD的神经退行性病变密切相关,这也预示着,p-tau 217是治疗AD的潜在靶点。
接下来,研究团队想评估一下mAb2A7的疗效。于是,研究人员构建了PS19 tau病理小鼠模型。由于雄性PS19小鼠tau蛋白磷酸化出现的比雌性小鼠更早,因此,研究团队决定使用雄性PS19小鼠进行所有的动物试验。此外,研究团队还对给药途径进行了探索,结果发现,鼻腔给药的方式能更高效地将抗体递送进入小鼠大脑。
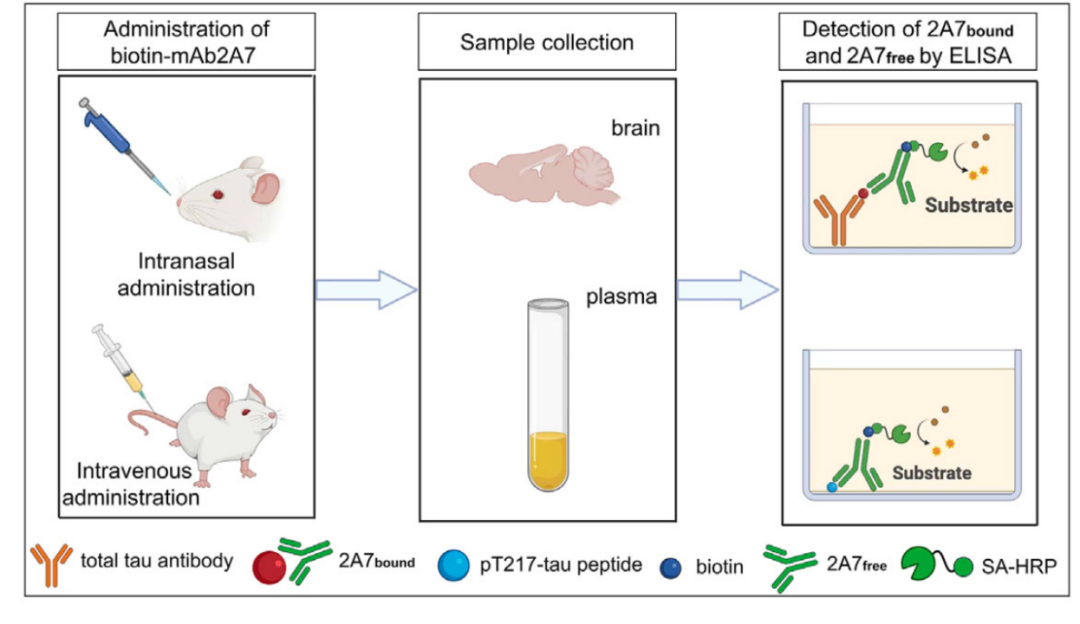
通过向5个月大的雄性PS19小鼠鼻腔注射mAb2A7(0.6 mg/kg/3天,持续3个月或5个月),研究团队发现,与对照组(注射IgG)相比,mAb2A7治疗显著减少了PS19小鼠海马区磷酸化tau蛋白的沉积。
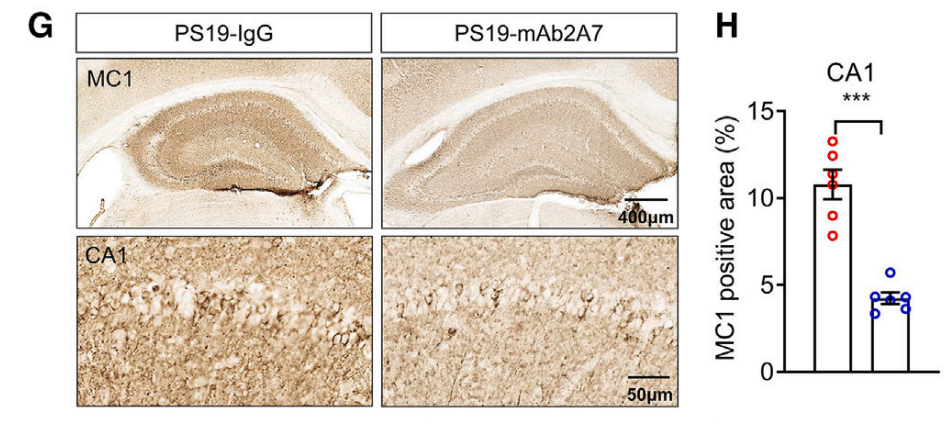
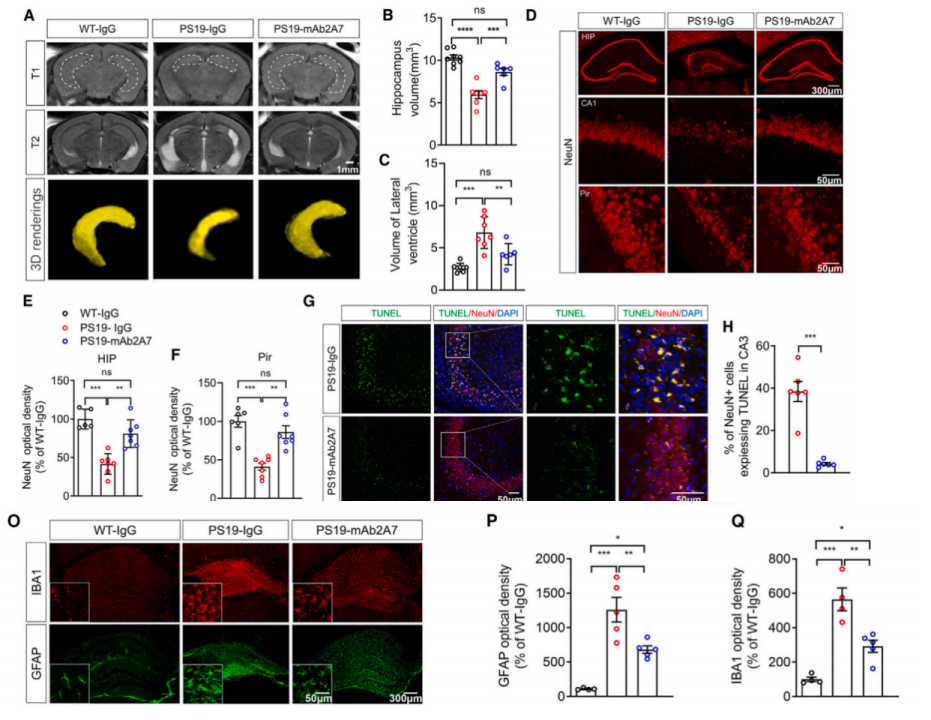
此外,在随后的包括生化分离试验、核磁共振成像分析、免疫染色等在内的多项实验结果显示,mAb2A7治疗不仅有效减少了PS19小鼠大脑中不可溶的p-tau和总tau水平,还减少了PS19小鼠因tau病理产生的脑萎缩。更重要的是,mAb2A7治疗能显著减轻神经元的丢失和凋亡以及突触损伤。
鉴于AD的另一个重要的病理特征为脑内的神经炎症,研究团队通过评估发现,mAb2A7治疗可显著减少小胶质细胞的激活,降低炎症因子的表达水平。
对PS19小鼠进行的多项行为学分析也显示,mAb2A7治疗不仅可减轻PS19小鼠的绝望或抑郁状态,还能逆转PS19小鼠的认知功能(治疗后新物体识别测试和水迷宫测试中表现与野生小鼠一致),并改善小鼠的运动能力。
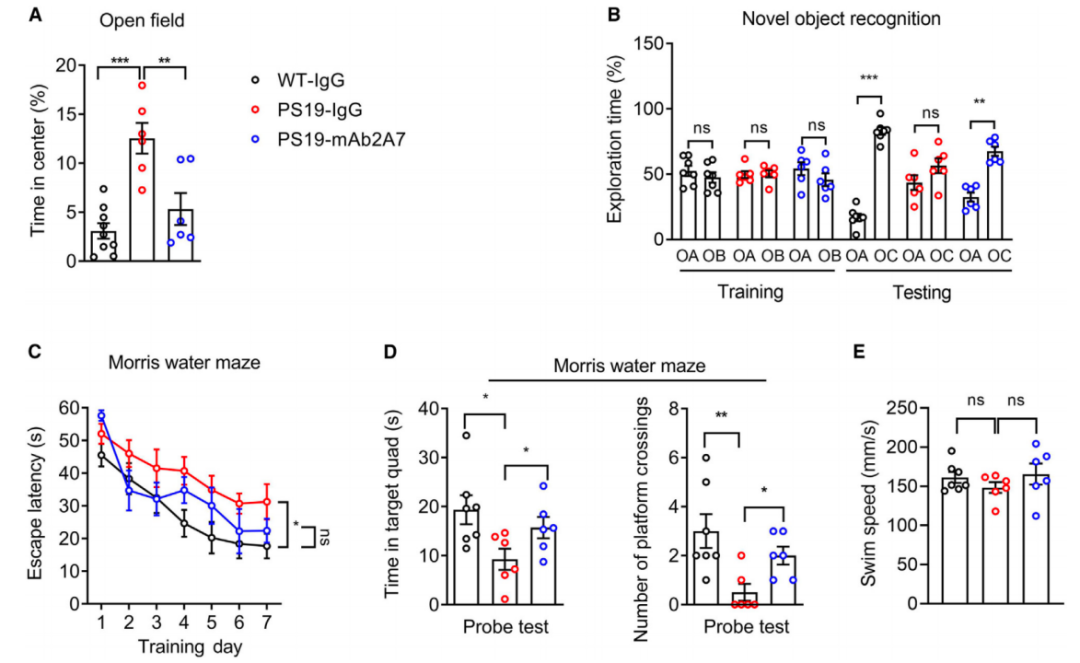
总之,以上结果均验证了,以p-tau 217为靶点的被动免疫疗法可改善小鼠的tau病理及相关的神经退行性病变。
最后,研究对PS19小鼠和野生小鼠的海马组织进行了蛋白质组学分析,结果发现,mAb2A7主要通过上调突触和神经元功能相关的蛋白表达,以及下调氧化应激和细胞凋亡相关的蛋白表达来恢复PS19小鼠大脑中的蛋白稳态。
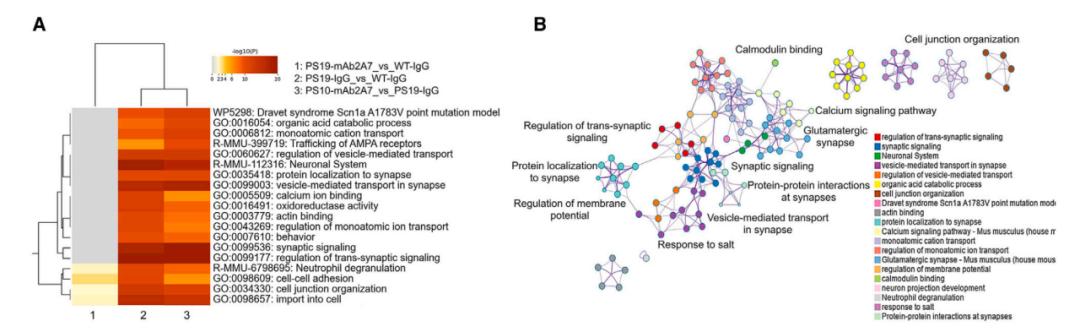
综上,该研究发现,以p-tau 217为靶点的被动免疫治疗是一种改善AD神经退行性病变的有效手段。
不过本文作者也表示,除p-tau 217外,其他过度磷酸化的tau蛋白,p-tau 181和p-tau 231也可能导致神经元损伤,未来还需要对这些磷酸点位的作用和致病机制进行分析。但不管怎么说,该研究结果无疑为AD的防治提供了新的方向。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


