《科学·信号》:科学家发现幽门螺杆菌感染诱发胃癌的新机制!
来源:奇点糕 2023-08-02 14:29
近日,日本顺天堂大学研究团队在
近日,日本顺天堂大学研究团队在Science Signaling期刊发表最新研究成果,揭示了CagA促进胃癌发生的最新机制:CagA可通过与VANGL1/2蛋白的相互作用干扰Wnt/PCP信号通路,促进胃内幽门腺基底细胞增殖并限制其分化,这种影响与CagA的其它促癌机制可能“沆瀣一气”,加速胃癌发病[1]。
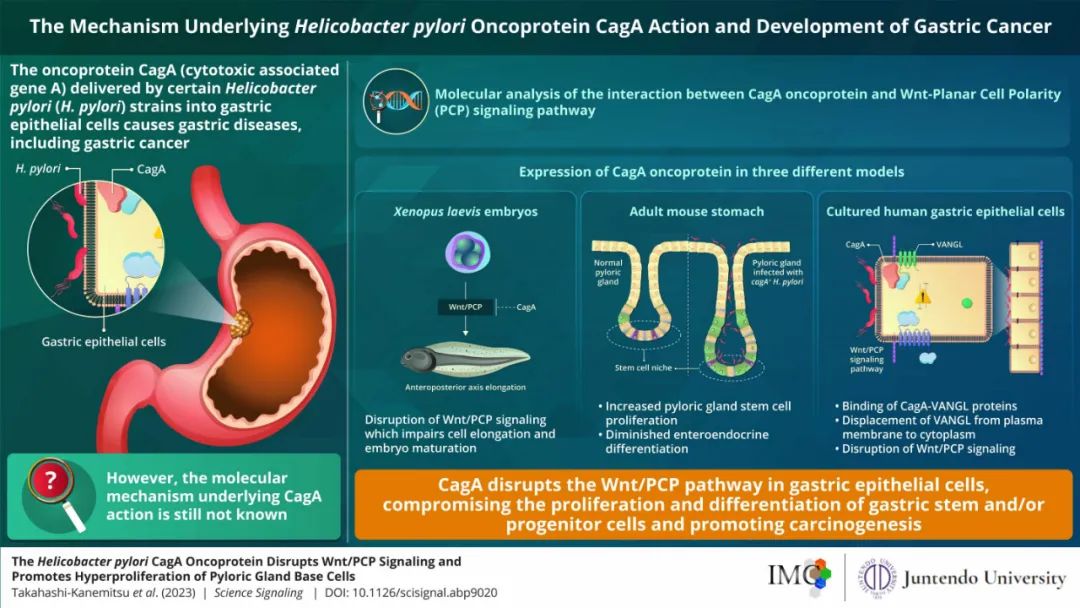
研究核心内容总结
各位读者对Wnt信号通路应该都不陌生,但PCP又是何方神圣呢?它的全称叫“平面细胞极性”,是指成片细胞在某一平面中形成的整体细胞极性,会对细胞提供方向性信息,参与组织形态发生、胚胎发育和器官形成等生理进程,比如果蝇体毛的排布其异常激活也与癌症发生有关,而PCP通路会受到非经典Wnt信号的调控[2]。
但顺天堂大学研究团队在研究之初,倒也没有直接把CagA的促癌作用与Wnt/PCP通路联系在一起;研究者们采用的实验方式,是让非洲爪蟾胚胎细胞表达CagA,观察它对胚胎发育的影响。实验显示,CagA会通过影响细胞的汇聚延伸运动(CEMs)导致神经管闭合失败(先天畸形的一种),而CEMs正是由Wnt/PCP通路调控。
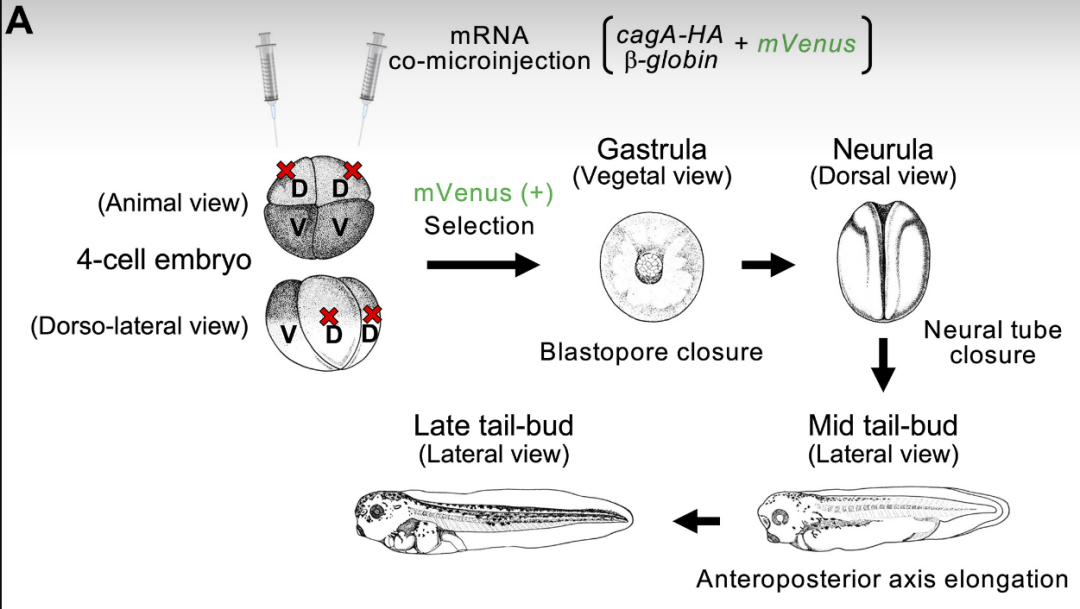
CagA影响CEMs,导致神经管闭合失败的实验过程
研究者们在人胃黏膜上皮细胞中复现了这种现象,并揭示CagA蛋白的N端可与VANGL1/2蛋白发生相互作用,使它们离开正常位置(即移位)。鉴于VANGL1/2蛋白是Wnt/PCP通路中的核心调控蛋白,CagA如何影响Wnt/PCP通路也就不言自明、一目了然了。
此前学界就有观点认为,Wnt/PCP信号通路会参与胃黏膜上皮细胞的癌变,并在癌症发生后促进癌细胞的侵袭和转移[3],那么在CagA蛋白这只“黑手”的影响下,情况又会怎样呢?
VANGL1/2蛋白又一次充当了“带路党”,研究者们采用免疫组化法分析小鼠胃时,发现在幽门腺基底细胞的细胞质膜表面,有大量异常表达的VANGL1/2蛋白,而让小鼠胃内特异性表达CagA后,它们也同样会出现移位。
CagA的影响还不止于此:与正常小鼠相比,胃内特异性表达CagA小鼠的幽门腺明显增长(也可称为变深),且细胞数增加、增殖加快,这可是很符合癌细胞特点的变化,但同时肠内分泌细胞(Enteroendocrine Cell)的标志物减少。
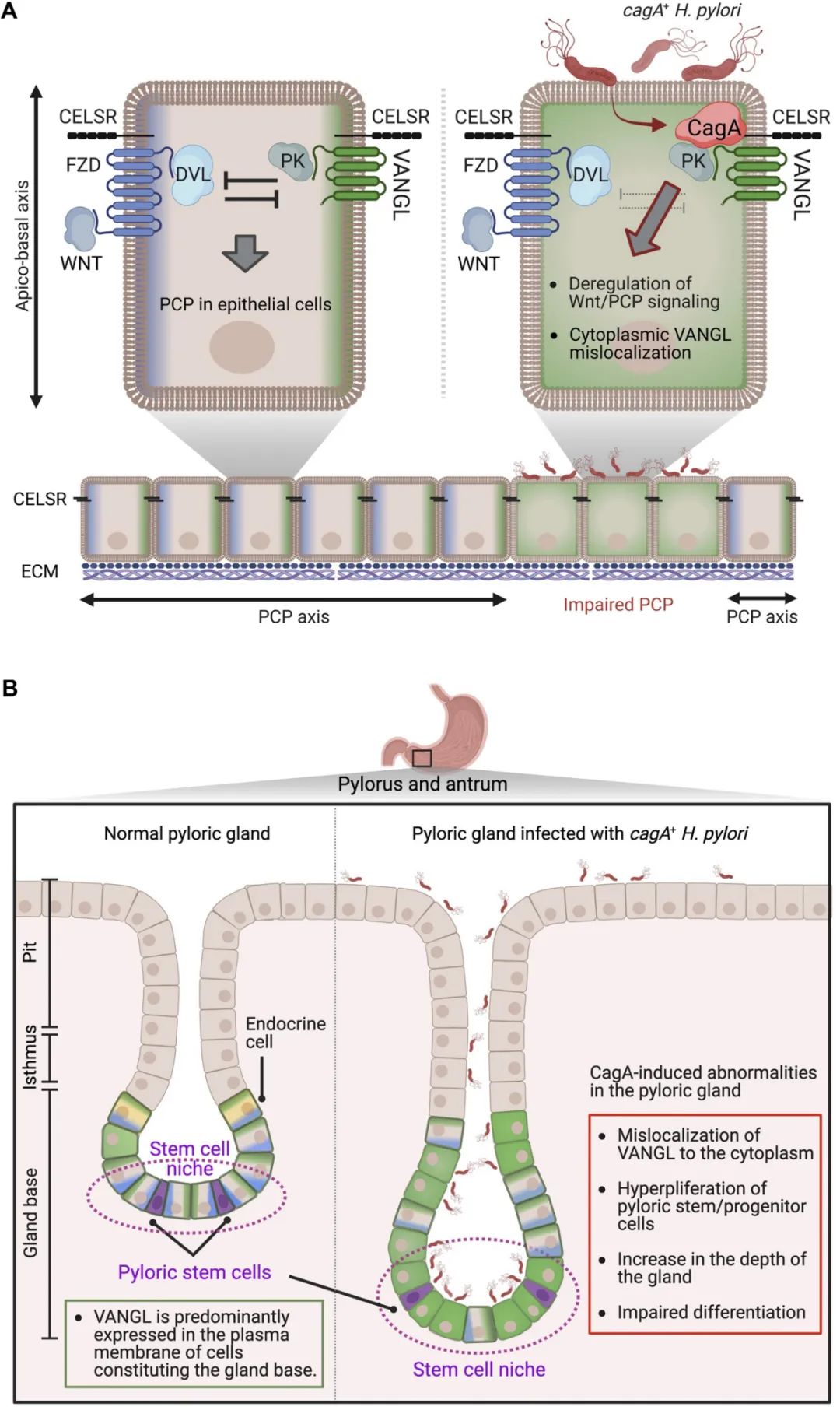
幽门腺“明显增长”
研究者们在论文中表示,本次CagA被发现对幽门腺形态的影响,可能与其它致癌机制产生“联动”,使一部分有干细胞特征的幽门腺基底细胞癌变,从而加速胃癌的发生发展,因此未来应考虑干预Wnt/PCP通路以治疗胃癌。
参考文献:
[1] Takahashi-Kanemitsu A, Lu M, Knight C T, et al. The Helicobacter pylori CagA oncoprotein disrupts Wnt/PCP signaling and promotes hyperproliferation of pyloric gland base cells[J]. Science Signaling, 16(794): eabp9020.
[2] 黄少勇, 蔡润泽, 陈永昌. 平面细胞极性通路在神经管缺陷中的作用[J]. 中国比较医学杂志, 2019, 29(7): 102-107.
[3] VanderVorst K, Hatakeyama J, Berg A, et al. Cellular and molecular mechanisms underlying planar cell polarity pathway contributions to cancer malignancy[C]//Seminars in cell & developmental biology. Academic Press, 2018, 81: 78-87.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


