「吃得咸」损伤免疫力但能增强抗癌能力?两项研究:高盐饮食可以增强T细胞的抗癌能力、抑制肿瘤生长,但对身体的影响弊大于利!
来源:生物谷原创 2024-09-08 10:31
尽管初步研究显示在特定条件下,如动物实验中,高盐可能促进免疫细胞的抗肿瘤活性,但这一潜在好处仍需严谨的人体临床试验来验证其有效性与安全性。
盐,这味在日常生活中不可或缺的调料,对于美食文化悠久深厚的中国来说,其在餐桌上的地位几乎不可动摇。无论是提鲜增味还是腌制保存,盐都扮演着至关重要的角色。
然而,随着公众健康意识的日益提升,科学膳食的概念逐渐深入人心,控制盐分摄入的重要性也日益受到重视。根据世界卫生组织的建议,成人每日食盐摄入量应限制在5克以内,以往的诸多研究也表明,过量摄入盐分是导致高血压的关键因素之一,而高血压又是心血管疾病、脑卒中及肾脏疾病等多种严重健康问题的主要诱因。因此,通过采取低盐饮食,我们可以有效地控制血压水平,降低罹患上述疾病的风险。
不过高盐对身体的影响可不仅限于心血管和电解质平衡。让我们展开来详细说说!
一. 钠离子水平与免疫系统功能密切相关
不久前,在《高血压》期刊上刊登的一篇题为“Sodium as an Important Regulator of Immunometabolism”的综述,梳理了食盐中的钠在人体生物学复杂机制中的关键调节作用,为我们重新认识食盐提供了新的视角。长期以来,钠主要因其对血压的影响而为人所知,但现在发现,它的影响力还深入到细胞和分子层面,对人体健康有着深远的影响。

随着时间的推移,科学家们对人体电解质平衡和钠调节的理解发生了显著变化。从最初简单的电解质分布模型,进而认识到钠的累积可以独立于水的累积。进一步研究发现,皮肤是钠的重要储存场所,且钠的排泄和保留存在独立的节律性模式。这些发现揭示了钠调节涉及免疫系统和局部组织环境的复杂系统,凸显了渗透压响应蛋白TonEBP(NFAT5)及单核吞噬细胞和淋巴网络在其中的作用。
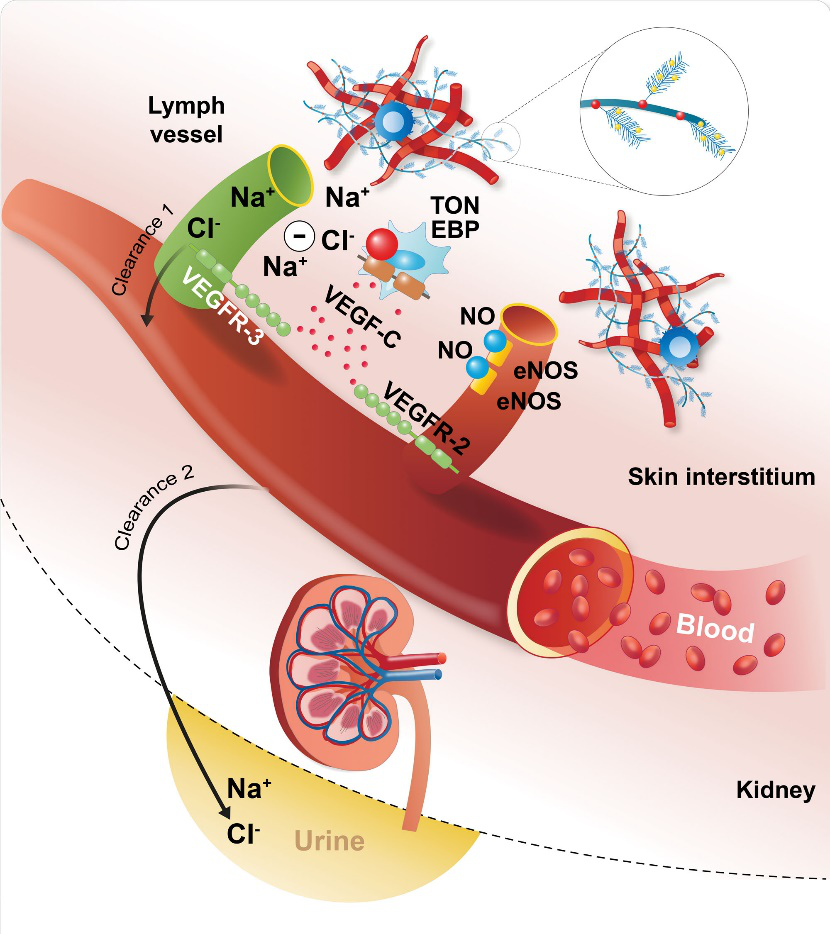
图1:局部(纳米域)钠梯度如何影响渗透压感受器、效应器和免疫细胞的示意图,图片来源自[1]
而最新研究表明,钠离子水平与免疫系统功能密切相关,高浓度的钠离子会促使免疫平衡向炎症倾斜。这一认识源于90年代早期研究,意外发现高钠浓度可激发免疫细胞促炎反应。后续研究揭示,高盐环境会激活促炎巨噬细胞和Th17细胞,抑制调节性和抗炎细胞。其中的机制涉及NFAT5、SGK1、p38/MAPK等复杂通路,且高盐会触发巨噬细胞代谢适应。
高盐摄入与自身免疫之间的联系之:Th17细胞与肠道微生物群
2013年的一项关键的发现指出高盐摄入或致实验性自身免疫,增强Th17细胞分化。人体实验结果也支持了此观点,显示短期高盐饮食会增加外周血Th17细胞。而高IL-17水平则关联高血压和多种自身免疫病。高盐还可以通过肠-脑轴引发肠道Th17反应,致神经血管失调和认知障碍。多种自身免疫病模型研究显示,高盐饮食会加剧症状。由此可见,高盐或激活T细胞亚群、促进IL-17产生,影响心血管和自身免疫病。
此外,近期研究还展现了钠摄入、肠道微生物组与免疫功能之间的复杂相互作用。研究表明,高盐摄入显著影响小鼠和人类的肠道微生物群,特别是减少有益的乳酸菌种类。这种微生物群变化与各种组织和器官中Th17细胞增加相关,加剧如实验性自身免疫性脑脊髓炎和盐敏感性高血压等疾病。
有趣的是,补充减少的乳酸菌种类,特别是鼠乳杆菌,可缓解这些负面影响。这可能通过增加细菌色氨酸代谢产物(如吲哚-3-乳酸)水平来抑制Th17细胞极化。这些发现与荟萃分析一致,表明益生菌(特别是含乳酸菌的)可能有助于降低高血压患者的血压。
此外,高盐摄入还改变肠道微生物群组成,增加厚壁菌门、变形菌门和普氏菌属等细菌种类,同时减少乳酸产生菌。这些变化使宿主易患炎症和高血压,粪便微生物移植实验证实了这一点。
高盐摄入与自身免疫之间的联系之:调节性T细胞
除了对肠道微生物群的影响外,高钠摄入还影响调节性T细胞(Tregs),这些细胞对维持免疫稳态和预防自身免疫至关重要。高盐条件可诱导Tregs获得更具炎症性的Th17样表型,可能损害其调节功能。这种盐诱导的Treg功能障碍可能促进自身免疫疾病和心血管疾病的发病和进展。
Treg功能障碍的机制涉及盐-SGK1信号轴,可诱导Tregs表达RORγt,使其向更具炎症性的表型转变。尽管FOXP3表达的适度变化不一定导致Treg身份和功能的完全丧失,但某些细胞因子(如IL-23或IL-1β)的存在可进一步推动这些细胞向更炎症性的状态发展。
高盐摄入与自身免疫之间的联系之:线粒体
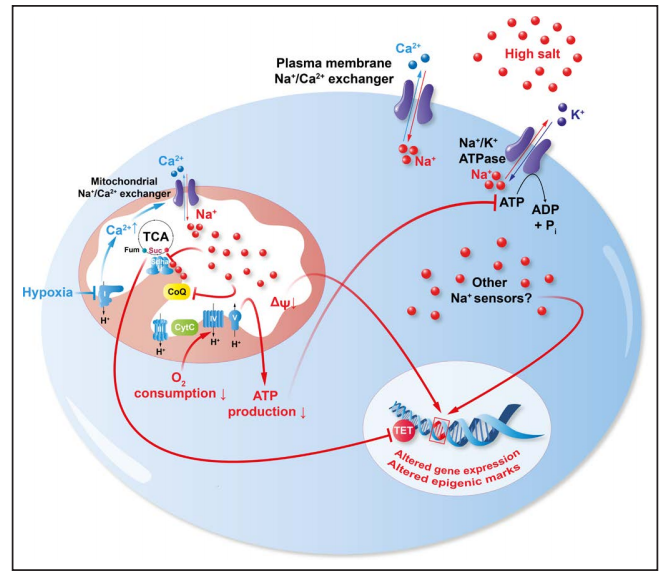 图2:在缺氧或高渗盐水条件下,钠和线粒体的代谢示意图,图片来源自[1]
图2:在缺氧或高渗盐水条件下,钠和线粒体的代谢示意图,图片来源自[1]
研究还发现钠与线粒体功能关系密切,能够影响细胞代谢和多种疾病。钠在细胞内积聚,尤其在线粒体内积聚,会损害其功能,影响其产生能量。心脏缺血时钠积聚,会减少线粒体呼吸和ATP生成,类似现象见于2型糖尿病,与心脏衰竭有关。
钠还影响免疫细胞,NCLX调控其跨膜作用。钠与线粒体膜磷脂相互作用,影响电子传递链,抑制功能,长期影响Tregs等细胞。高盐还诱导表观遗传变化,影响代谢途径,如促进有氧糖酵解,减少氧化磷酸化。
不过,高盐饮食难道就没有一点好处了吗?
二. 高盐饮食可以增强T细胞的抗癌能力?!
在刚刚过去的8月份,《自然·免疫学》上发表了意大利研究团队的最新发现:食盐可以增强杀伤性T细胞的抗肿瘤免疫力。通过小鼠实验,他们发现高盐饮食可以增强T细胞的抗癌能力,并能够抑制肿瘤生长。

研究小组首先采用高浓度盐溶液(80mM)对CD8+初始T细胞进行处理,同时辅以anti-CD3/CD28抗体和IL-2以激活T细胞。为模拟高盐环境下的渗透压效应,他们另设一组T细胞作为对照组,仅使用尿素和甘露醇处理,此处理对T细胞影响甚微。
实验结果显示,相较于对照组,高盐处理显著提升了颗粒酶B(GZMB)及TIM3基因的表达水平,标志着活化的效应记忆T细胞的生成。RNA测序进一步揭示,高盐环境触发了转录组层面的广泛变化,特别是与效应功能及细胞毒性相关的基因(如IFNG、TNF、GZMB、TBX21)以及干性相关基因(如FOXO1、RUNX1、SATB1、ID3)的上调。
此外,研究还发现,高盐环境促进了T细胞代谢的关键调控因子MYC、糖酵解途径中的PKM和LDHA,以及谷氨酰胺转运蛋白SLC1A5和SLC7A5的表达,表明高盐能够重塑T细胞的代谢模式。功能分析显示,高盐处理增强了T细胞产生干扰素-γ(IFNγ)和脱颗粒标志物CD107a的能力,并在体外实验中展现出更高的黑色素瘤细胞杀伤效率。值得注意的是,高盐效应的发挥依赖于T细胞受体(TCR)的激活。
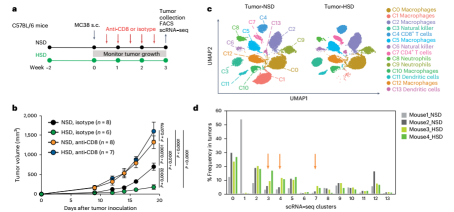
图3:体内实验的设计示意图(a);喂食正常盐饮食(NSD)或高盐饮食(HSD)的雄性B6小鼠在接受抗CD8抗体或对照抗体处理后的MC38肿瘤平均体积(b);喂食NSD或HSD的小鼠在肿瘤接种后第19天采集的单细胞RNA测序(scRNA-seq)数据(c);小鼠中每一个簇的细胞频率条形图,箭头标出了在喂食高盐饮食的小鼠中发生变化的簇(d),图片来源自[2]
基于上述发现,研究团队推测高盐可能促进人CD8+T细胞的效应分化。随后,他们大胆地将研究延伸至体内环境,探究高盐饮食对小鼠抗肿瘤免疫的影响。通过给小鼠提供高盐饮食(食物含盐4%,饮水含盐1%),并在两周后接种MC38结肠腺癌细胞,他们发现高盐饮食导致肿瘤内氯化钠积聚,同时显著抑制了肿瘤生长。然而,当CD8+T细胞被特异性清除后,高盐的抗肿瘤效果消失,表明CD8+T细胞是此效应的关键。
深入分析显示,高盐饮食组小鼠肿瘤内CD8+T细胞、自然杀伤细胞及CD4+T细胞的比例显著增加,且CD8+T细胞的转录谱发生积极变化,表现为终末分化和衰竭相关基因的下调和细胞毒性、活化及效应分化相关基因的上调。这些变化与PD-1抑制剂诱导的效应相似,提示高盐饮食可能通过类似机制促进免疫激活并抑制免疫抑制。
进一步机制研究表明,高盐饮食通过上调谷氨酰胺转运体表达,促进CD8+T细胞对谷氨酰胺的摄取,进而通过代谢产生的αKG激活去甲基化酶,如TET和JMJD3,从而增强效应分子基因位点的染色质可及性,实现T细胞的重编程和抗肿瘤活性的增强。
在这里,我们需要特别指出的是,该研究中定义的“高盐饮食”是指食物中含有4%的盐分。为了直观地理解,我们假设一顿饭吃250克这样的高盐食物,那么就会摄入大约10克的盐,这几乎是世界卫生组织建议的日摄入量(5克)的两倍!不过,更值得注意的是,即使4%的含盐量在研究中被视为高水平,但相较于某些日常调味品或加工食品而言,4%的盐分其实并不算极端。例如,市面上不少酱油产品的含盐量可以轻松达到15%至20%,这就已远超实验中所用的4%。
小结
人体生理机制本身十分复杂,因此高盐饮食对健康的影响也同样复杂多面。尽管初步研究显示在特定条件下,如动物实验中,高盐可能促进免疫细胞的抗肿瘤活性,但这一潜在好处仍需严谨的人体临床试验来验证其有效性与安全性。
相比之下,高盐饮食对心血管系统、肾脏、骨骼及消化系统等造成的负面影响更为显著,包括增加高血压、心脏病、中风的风险,加重肾脏负担,损害骨骼健康,以及可能诱发消化系统问题。
鉴于医学研究的深入性和严谨性,我们愈发清晰地认识到,高盐饮食并非一种健康的饮食习惯。它带来的健康风险远超过其可能带来的有限好处。因此,为了维护身体的整体健康,我们还是应积极倡导并实践低盐饮食的生活方式,减少盐分摄入,从而降低罹患多种慢性疾病的风险。
参考文献:
1. Miyauchi, H.; Geisberger, S.; Luft, F.C.; Wilck, N.; Stegbauer, J.; Wiig, H.; Dechend, R.; Jantsch, J.; Kleinewietfeld, M.; Kempa, S.; et al. Sodium as an Important Regulator of Immunometabolism. Hypertension, 2023
2. Scirgolea, C., Sottile, R., De Luca, M. et al. NaCl enhances CD8+ T cell effector functions in cancer immunotherapy. Nat Immunol (2024). https://doi.org/10.1038/s41590-024-01923-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


