Nature系列综述:癌症疫苗,下一个免疫治疗前沿
来源:医药速览 2022-09-22 13:45
传统疫苗致力于预防多种传染性疾病,而近年来受人瞩目的癌症疫苗,其目标是将人体免疫系统的力量集中在肿瘤细胞的消除上。
传统疫苗致力于预防多种传染性疾病,而近年来受人瞩目的癌症疫苗,其目标是将人体免疫系统的力量集中在肿瘤细胞的消除上。癌症疫苗治疗能够引起大肿瘤的全身性消退以及延长患者的生存期。尽管现有的免疫疗法(如免疫检查点抑制剂以及嵌合抗原受体T细胞等)在肿瘤治疗领域已经取得了显著的成果,然而肿瘤疫苗有其独特优势,例如肿瘤疫苗可以靶向除肿瘤特异性表面抗原以外的细胞内抗原,甚至可能引发新的肿瘤特异性T细胞反应。但当前已经开展的癌症疫苗的临床试验数量有限,其治疗效果以及详细且明确的原理需要研究者们的进一步探索、确认。
在此,文章将关注当前出现的不同类型的肿瘤疫苗,以及肿瘤疫苗所包含的不同抗原类型,介绍多种肿瘤疫苗的特性及其临床成就。

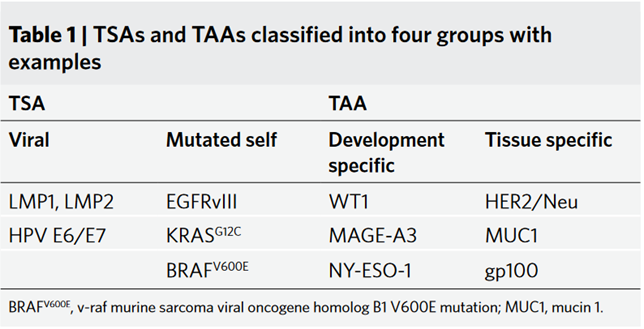
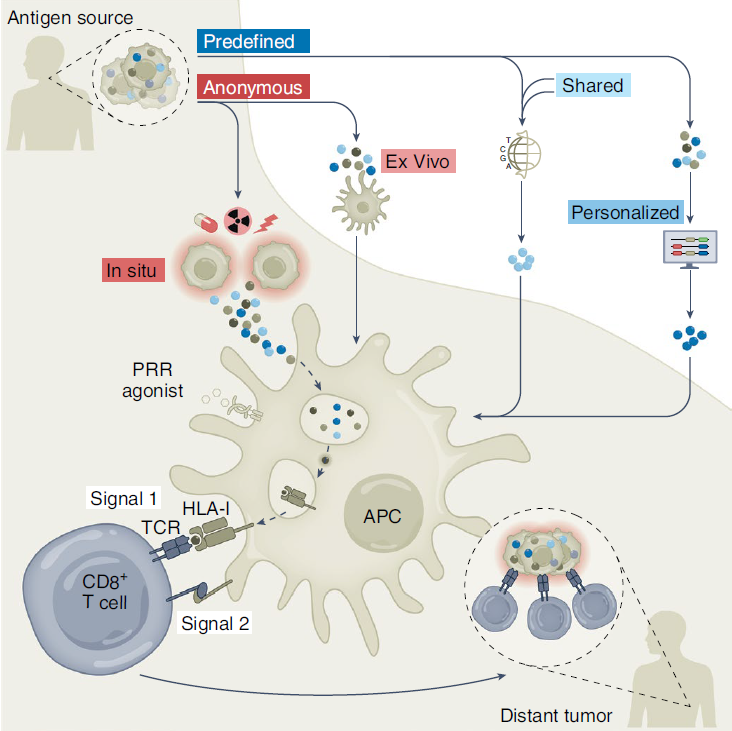
肿瘤抗原常常被分为肿瘤特异性抗原(TSA)和肿瘤相关抗原(TAA)(Table 1)。TSA包括病毒抗原和由非同义体细胞突变产生的新表位,TAA则包括组织特异性抗原和发育特异性抗原。癌症疫苗发挥作用的方式为通过APC对肿瘤抗原进行摄取并将其在HLA-Ⅰ上呈递给CD8+ T细胞。通过激活载有肿瘤抗原的DC,癌症疫苗可以诱导针对肿瘤抗原的免疫反应。不同类型的癌症疫苗有不同的将肿瘤抗原与交叉呈递的DC共定位的方法(图2)。
预定义抗原在治疗前即对肿瘤抗原有了较清楚的定义。而预定义抗原又可以通过跨患者群组的表达频率进一步分类。共享抗原为在足够比例的患者中表达的抗原,免疫学家可以使用标准测试针对肿瘤患者,并且由此发展的共享抗原疫苗可以同时靶向TSA和TAA。个性化抗原对接种疫苗的患者而言是独一无二的,通常由TSA新表位组成,针对大群体患者而言不够普遍。
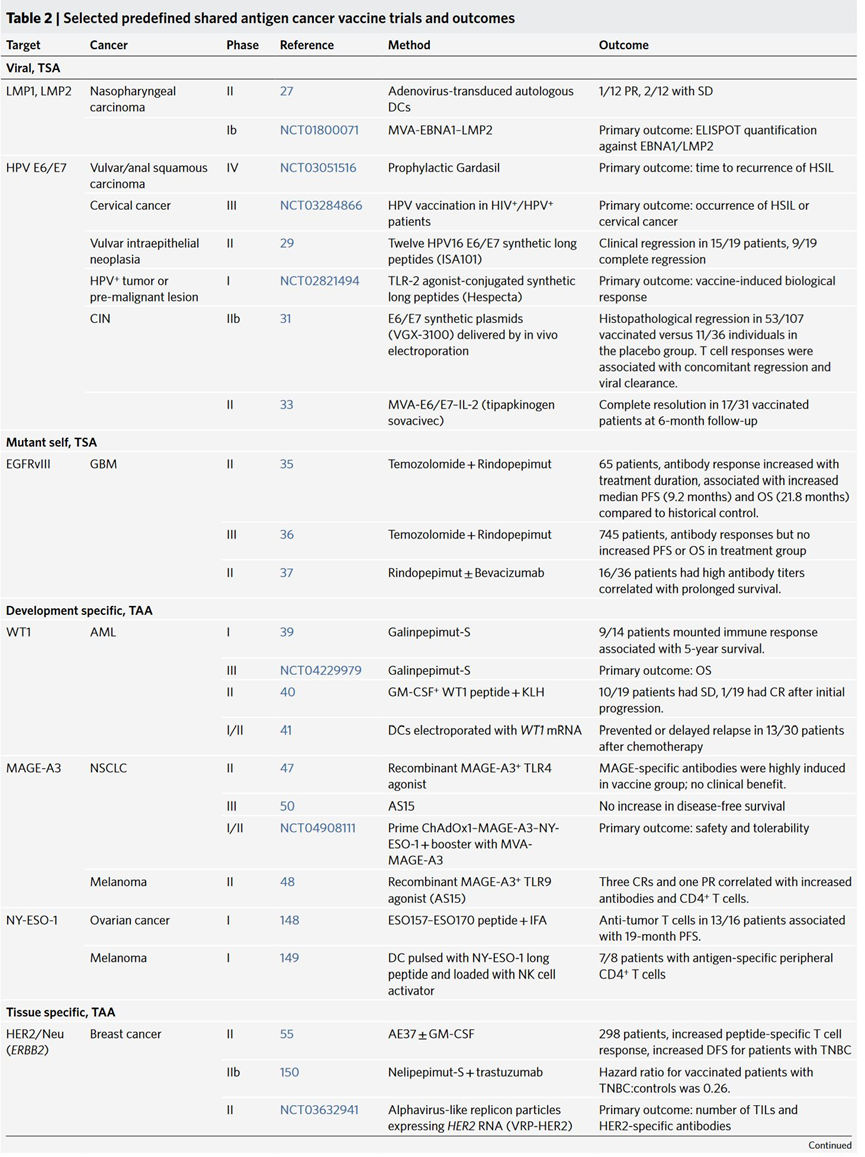
预定义共享抗原疫苗可以视为治疗中的“现成”疗法,大多数是根据早期试验中累计的临床和免疫学数据得出的最佳共享抗原。Table 2 中列举了这些预定义共享抗原的显著免疫学或临床成就。
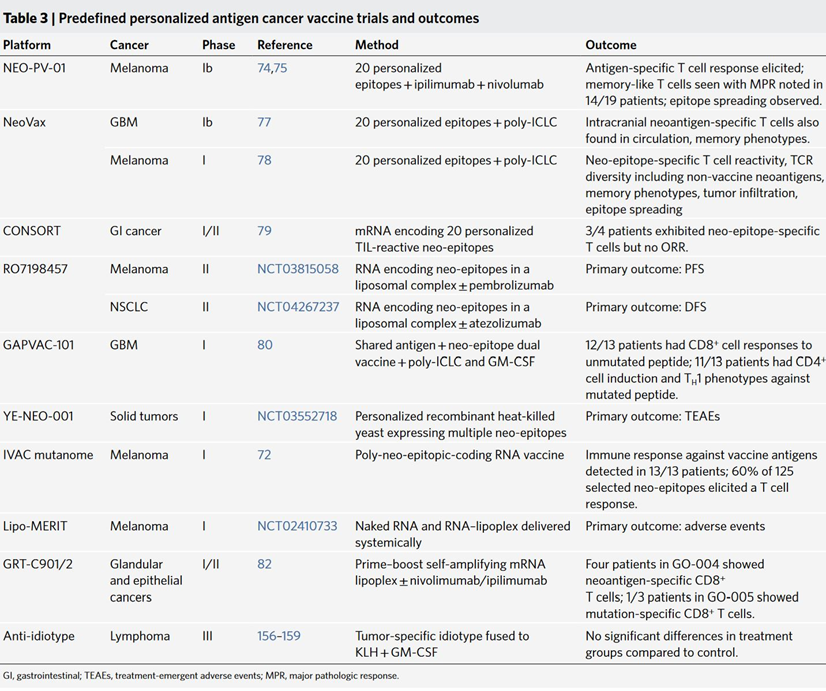
与共享抗原不同,个性化抗原仅针对一名患者,最常见的是新表位TSA。靶向个性化抗原的优势在于可以实现较高的特异性,并且能够与检查点阻断治疗相结合,对有治疗响应的患者增加其体内T细胞的反应性。新一代测序是的个体化抗原疫苗的设计更加可行和有效。通过从肿瘤和生殖系组织中提取DNA和RNA的变种,用于外显子组和RNA测序以及HLA分型。选择存在于肿瘤中但不存在于种系中、具有低“错误发现率”并导致非同义蛋白质变化的体细胞突变。使用类似于 NetMHC 算法的方法,通过计算机预测它们与患者的 HLA 等位基因的结合,从体细胞突变中选择潜在的免疫原性新表位。Table 为现有的预定义个性化抗原疫苗试验及其结果。预定义个性化抗原疫苗可以用最佳计算方法确定最特异性肿瘤诱变剂,以减少为每位患者生产个性化疫苗所需的资源量,避免异质肿瘤的免疫逃逸,并且建立有效的抗肿瘤CD8+ T细胞免疫。
匿名抗原在治疗前未被定义,其进一步的分类可以通过与APC的加载位置来分类,而不是根据抗原身份进行分类。
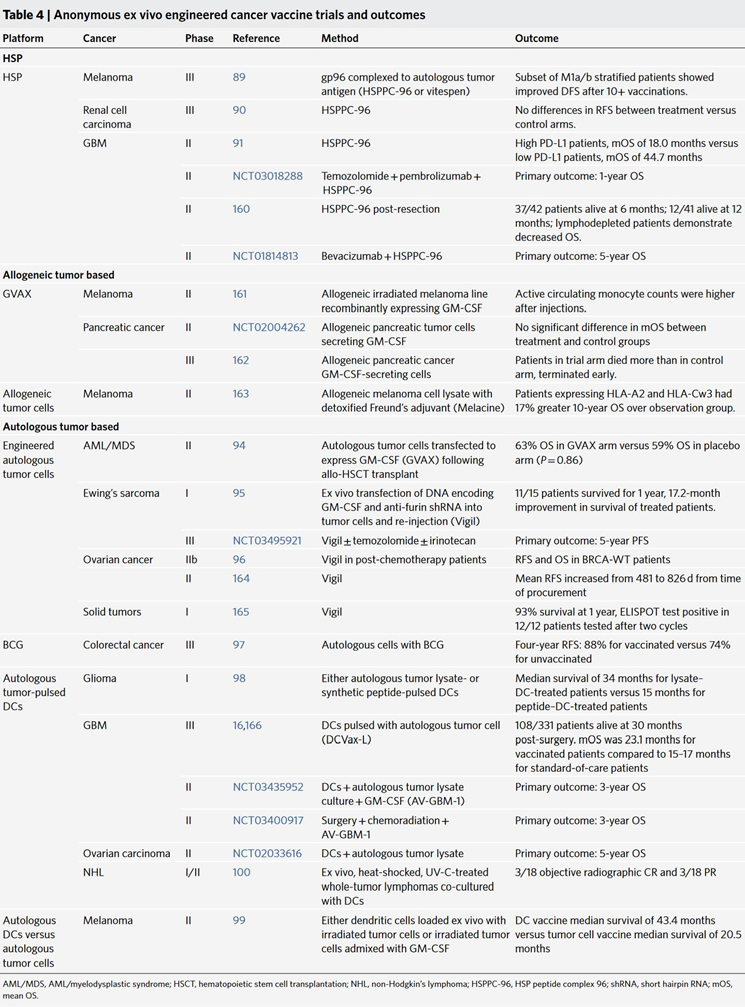
离体匿名抗原疫苗来自被切除的肿瘤细胞(切除活检),这些细胞裂解后被加工成更具有抗原性的形式并与APC共定位。注射的肿瘤细胞可能被吸收后递送至自体APC,或者肿瘤细胞本身会将其抗原呈递给T细胞。(Table 4)研究表明,以自体肿瘤裂解物为基础的疫苗制备方法比共享抗原更有效,并且匿名抗原离体疫苗具有更大的呈现全谱肿瘤抗原的潜力,在诱导全身性肿瘤消退方面已被证明有功效。
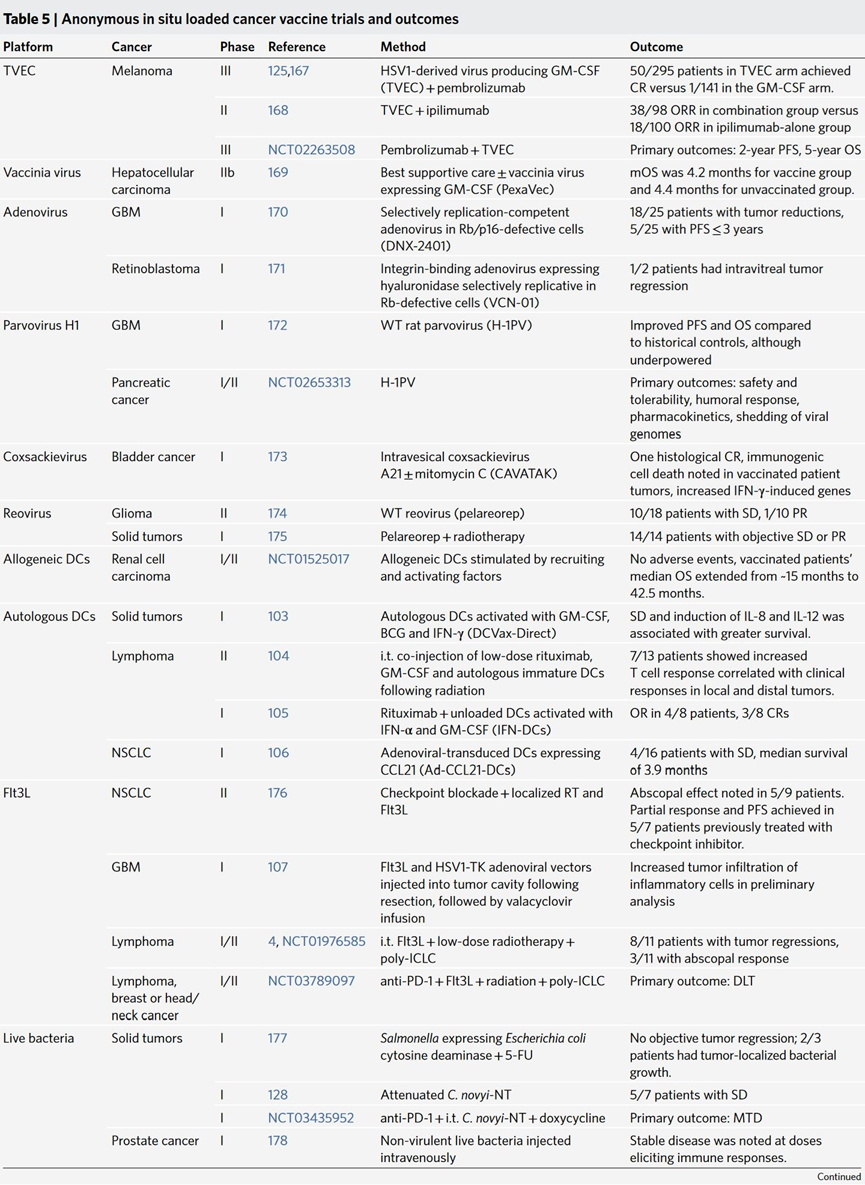
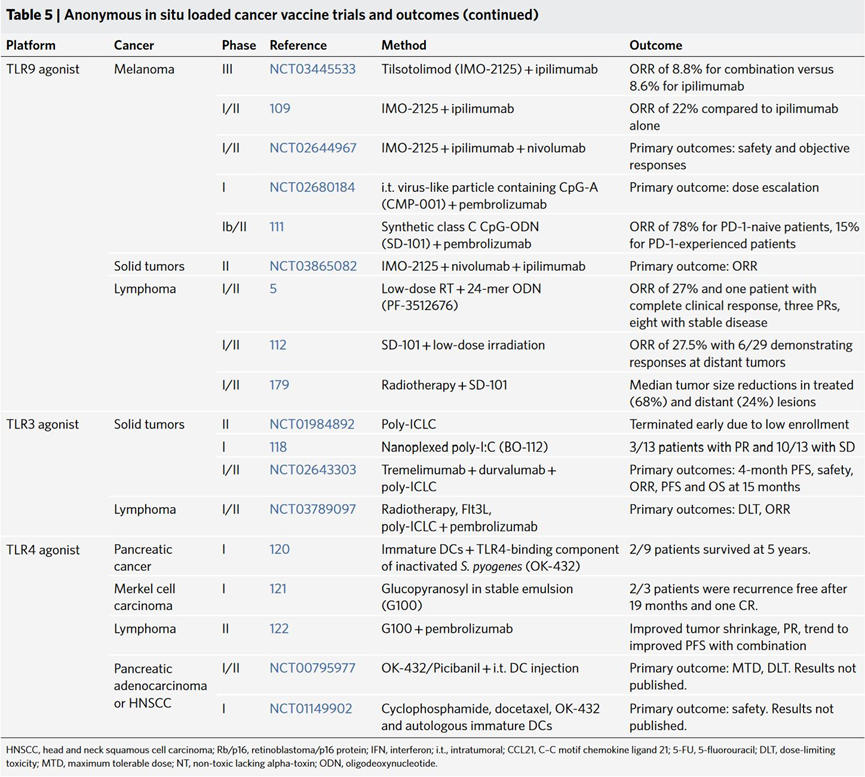
原位匿名抗原疫苗类似体外疫苗,其发挥功能的方式在于诱导APC募集和肿瘤抗原负载以及激活,以便APC可以有效地交叉引发肿瘤反应性T细胞。原为疫苗接种结合了全谱肿瘤抗原的免疫学益处和现成方法的实用性,可以进行多种类型的肿瘤内给药,包括病毒、PRR 激动剂和其他免疫刺激剂。(Table 5)
肿瘤细胞既排除又灭活DC细胞,因此研究者试图通过直接瘤内给药补给DC细胞,用于随后摄取和呈递肿瘤抗原。以这种方式注射体外成熟和活化的自体 DC,能够增加与疾病稳定和延长生存期相关的肿瘤内细胞因子水平(例如,IL-12p40、IL-8、肿瘤坏死因子(TNF)等)。
Flt3L 是主要的造血祖细胞生长和分化因子,能够负责动员DC,尤其是交叉呈递的亚群cDC1。因此,Flt3L 给药可能是一种比直接注射补充瘤内DC更实用的方法。目前已有Flt3L 制剂结合PD-1阻断剂治疗淋巴瘤等癌症,以及其他Flt3L 制剂进入临床阶段,尽管Flt3L 制剂进展受到日常给药和可用临床试剂的限制的阻碍,但Flt3L 制剂给药仍具有很大潜力。
TLR 是单次跨膜 PRR 家族受体,在众多白细胞亚群上表达,例如髓细胞和 DC,可识别结构上保守的病原体相关分子模式。已鉴定出10种人和13种鼠类 TLR,每一种都具有不同的病原体相关分子模式识别。已开发合成 TLR 激动剂来激活几种人类 TLR,并有望引发抗肿瘤免疫反应。
溶瘤病毒在肿瘤细胞中的优先复制和细胞溶解可以产生许多治疗机制,其中的主要关注点是它们在肿瘤内给药后具有潜在的全身疫苗效应。目前,唯一获得美国食品和药物管理局批准的溶瘤病毒是 talimogene laherparepvec (TVEC),这是一种改良的、产生GM-CSF的HSV1病毒,注射后可增加存活率并且能在与检查点阻断的新辅助和联合试验中使病变中的肿瘤消退。类似地,减毒的诺氏梭菌瘤内注射已证明能够诱导肿瘤特异性T细胞和肿瘤消退并且现在正在与PD-1阻断联合使用。
表5:匿名原位装载癌症疫苗试验和结果
展望
癌症疫苗的研究经历了许多失败,当前CAR-T以及双特异性T细胞结合剂等产品的成功在一定程度上验证了癌症疫苗原理的可行性。然而如何优化cCD1交叉呈递以及通过何种方式测量疫苗接种患者体内交叉引发的肿瘤反应性T细胞是有待解决的问题。
在评估抗肿瘤疗效前测量药效是癌症治疗发展的黄金标准。研究表明,抗肿瘤的T细胞反应对疫苗的抗肿瘤效果至关重要。目前已有酶联免疫吸收点(ELISPOT)或是流式细胞仪分析来评估使用T细胞-肽共培养的预定义抗原疫苗的肿瘤反应性T细胞的功能。针对当前新的治疗方法——疫苗与检查点阻断联合治疗,研究者们也开发了MANAFEST等检测方法,将功能性T细胞反应性检测(针对新表位)与实用的描述性检测(如TC测序)结合起来,允许在血液或肿瘤中连续检测后者以测量抗肿瘤T细胞反应。这种检测方法超越新表位反应性,并探测整个肿瘤细胞的反应性,以允许测量对匿名肿瘤抗原疫苗的免疫反应。
数年研究进展表明,癌症疫苗确实能够引起全身性肿瘤消退并得到持久的缓解和OS改善。但需要研究者们站在巨人的肩膀之上,运用前人的研究成果合理开发有效安全的癌症疫苗,将免疫治疗和肿瘤治疗推入新的时代。
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->