Nat Nanotechnol | 浙江大学林贤丰/范顺武发现靶向初始肿瘤-破骨细胞时空相互作用以防止骨转移
来源:生物探索 2024-03-20 09:39
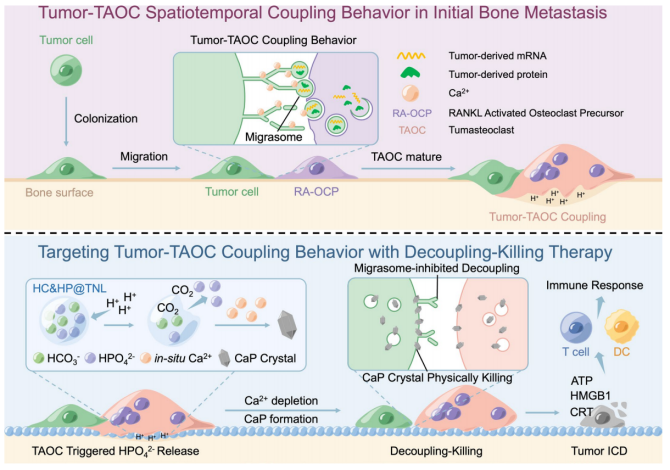
该研究发现肿瘤-破骨细胞通过迁移体介导的细胞质转移到核因子κ-β配体受体激活剂(RANKL)活化的破骨细胞前体(RA-OCPs)的时空偶联。
浙江大学林贤丰及范顺武共同通讯在Nature Nanotechnology 在线发表题为“Targeting initial tumour-osteoclast spatiotemporal interaction to prevent bone metastasis”的研究论文,该研究表明靶向初始肿瘤-破骨细胞时空相互作用可以防止骨转移。
该研究报道了肿瘤细胞和破骨细胞之间的时空耦合相互作用,并将肿瘤相关的破骨细胞命名为“破骨细胞”-肿瘤迁移体介导的细胞质转移诱导的骨转移中的破骨细胞亚型。随后,提出了一种原位解耦杀伤策略,其中四环素修饰的纳米脂质体包裹碳酸氢钠和磷酸氢钠,设计用于特异性释放由破胃细胞触发的高浓度磷酸氢离子,从而耗尽钙离子并形成钙磷晶体。这可以抑制迁移体的形成进行解耦,破坏细胞膜进行杀伤,从而实现骨转移的早期预防。该研究为详细探索肿瘤细胞行为提供了一个研究模型,并为行为靶向策略提供了概念验证。

转移的进展导致90%以上的癌症死亡,并伴有肿瘤细胞恶性增殖引起的器官功能障碍。然而,与通常用局部手术或放疗治疗的原发性肿瘤不同,肿瘤转移是一种全身性疾病。由于肿瘤细胞在长期的早期阶段处于潜伏的非增殖状态,并通过肿瘤微环境的形成逃避免疫监视,基于单分子或信号通路的治疗由于异质蛋白、信号绕道和肿瘤异质性的存在,容易产生耐药,从而导致药物和生化耐药,降低化疗等现有治疗的有效性。然而,随着早期肿瘤微环境形成行为的持续进行,诱导肿瘤基质细胞的基本行为本身可能是一个未被注意到的新靶点。
在肿瘤转移的众多器官中,骨是许多恶性肿瘤最常见的优先转移部位,尤其是乳腺癌和前列腺癌。最近的研究报道,骨微环境中肿瘤细胞的重编程促进了其他器官如肺、肝和脑的继发性转移。预防危重骨转移是预防系统性肿瘤转移的重要环节。由于骨基质的特殊硬基质界面,软化骨基质是初始转移的先决条件。因此,唯一具有酸分泌和骨质溶解功能的细胞—破骨细胞—被认为是肿瘤骨转移初始微环境的关键。尽管在过去的研究中已经从外泌体或细胞因子的角度讨论了肿瘤诱导的破骨细胞形成过程,确切的过程和时空特征尚无定论。
模式图(Credit: Nature Nanotechnology)
该研究发现肿瘤-破骨细胞通过迁移体介导的细胞质转移到核因子κ-β配体受体激活剂(RANKL)活化的破骨细胞前体(RA-OCPs)的时空偶联。将这种肿瘤相关破骨细胞命名为“破骨细胞”(TAOC),并根据其诱导模式(需要接触)、诱导介质(迁移体)和转录模式(替代转录因子途径)对其进行了定义。基于肿瘤-TAOC在初始转移过程中耦合的时空特征,进一步构建了靶向骨、四环素修饰的包裹碳酸氢钠和磷酸氢钠的纳米脂质体(HC&HP@ TNL)。
在转移初期,当肿瘤-TAOC偶联形成时,TAOC会触发HC&HP@TNL释放出高浓度的磷酸氢钠。磷酸氢与微环境中的钙离子结合,形成原位钙磷(CaP)晶体,降低钙浓度,抑制迁移体形成,破坏细胞膜完整性,诱导免疫原性细胞死亡(ICD)。基于肿瘤- TAOC耦合行为的时空特征,提出了一种初始转移(避免药物耐药)的行为靶向策略,通过TAOC触发的原位解耦-杀伤脂质体系统诱导CaP晶体物理杀伤(避免生化耐药),以准确地基于源预防肿瘤转移。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


