盘点:2022年终盘点:癌症疫苗重要研究成果解读
来源:生物谷原创 2022-12-27 10:13
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在癌症疫苗研究领域取得了多项重要研究成果
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在癌症疫苗研究领域取得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
【1】JAMA Oncol:3期非盲临床试验表明利用树突细胞构建的疫苗有望治疗胶质母细胞瘤
Linda M. Liau,Keyoumars Ashkan,Steven Brem,et al. Association of Autologous Tumor Lysate-Loaded Dendritic Cell Vaccination With Extension of Survival Among Patients With Newly Diagnosed and Recurrent Glioblastoma,JAMA Oncology,2022,doi:10.1001/jamaoncol.2022.5370.
近日,一篇发表在国际杂志JAMA Oncology上题为“Association of Autologous Tumor Lysate-Loaded Dendritic Cell Vaccination With Extension of Survival Among Patients With Newly Diagnosed and Recurrent Glioblastoma”的研究报告中,来自英国伦敦国王学院等机构的科学家们通过进行一项3期非盲临床试验,结果表明,一种称为DCVax-L的疫苗或能利用患者机体的免疫细胞靶向攻击脑癌,可以将患者的生存期延长许多个月,在某些情况下甚至是几年。

图片来源:JAMA Oncology,2022,doi:10.1001/jamaoncol.2022.5370.
这是17年来首次在新诊断的胶质母细胞瘤患者中进行全身性治疗的3期临床试验中取得如此重大的成果,也是27年来首次有一种治疗方法被证明能够延长复发性胶质母细胞瘤患者的生存期。这种疫苗是通过从患者的血液中分离出特定的免疫细胞(称为树突细胞),为每名患者单独研制的。然后用来自患者肿瘤样本的生物标志物对这些细胞进行诱导。当含有这些细胞的疫苗被注射回患者体内时,它就会分享这些信息,从而使身体的整个免疫系统识别并攻击目标。
该疫苗试验了八年,涉及来自英国、美国、加拿大和德国的300多名患者---他们都被诊断出患有胶质母细胞瘤,这是成年人中最具侵袭性的脑瘤形式。在随机分组后,新诊断为胶质母细胞瘤的患者在接受这种疫苗治疗后平均存活了19.3个月(手术移除后22.4个月),而对照组为16.5个月。接受这种疫苗治疗的复发性胶质母细胞瘤患者平均存活了13.2个月,而对照组则为7.8个月。
在接受这种疫苗治疗的患者中,13%的人在诊断后至少存活了5年,而对照组只有5.7%,其中最长的存活者超过了8年。在随机分组后,接受这种疫苗治疗的携带甲基化MGMT基因的患者平均存活了30.2个月(手术移除后33个月),而对照组为21.3个月。与化疗和放疗不同,绝大多数患者报告说这种免疫治疗疫苗没有副作用。在参与这种治疗的331名患者中,只有5人报告了明显的不良反应,这可能与他们的治疗有关。
【2】Cell:实验性癌症疫苗的开发在动物研究中获得重大进展!
Faezzah Baharom,Ramiro A. Ramirez-Valdez,Ahad Khalilnezhad,et al. Systemic vaccination induces CD8+ T cells and remodels the tumor microenvironment,Cell (2022). doi: 10.1016/j.cell.2022.10.006
治疗性癌症疫苗旨在增强机体肿瘤特异性T细胞的免疫力,然而,肿瘤微环境中的抑制性机制或许会限制T细胞的功能。近日,一篇发表在国际杂志Cell上题为“Systemic vaccination induces CD8+ T cells and remodels the tumor microenvironment”的研究报告中,来自美国国立卫生研究院等机构的科学家们通过研究开发出了一种实验性的治疗性癌症疫苗,其或能诱导产生两种不同的、理想的免疫系统反应,从而就能明显导致小鼠机体肿瘤的消退。
研究者发现,静脉注射这种新型疫苗或能增强能够浸润且攻击肿瘤细胞的细胞毒性T细胞的数量,并能通过诱导I性干扰素的产生来参与机体的先天性免疫系统反应。先天性免疫反应会改变机体的肿瘤微环境,并抵消原本会抑制T细胞活性的抑制力量,在通过针头注射到皮肤(皮下注射方式)接受疫苗的小鼠中,研究人员并未观察到肿瘤微环境的改变。
研究人员将这种新方法称之为“vax-innate”,这种方法实现了科学家们寻求治疗癌症的更加有效的免疫性治疗疫苗的一个重要目标,此外,本文研究结果表明,通过静脉注射疫苗的方式或能通过克服肿瘤诱导的免疫抑制活性,从而就能实现并增强T细胞的免疫力。这种候选疫苗还能通过静脉注射给已经接受肿瘤特异性T细胞作为疗法的人群,研究人员指出,其还能通过增加T细胞的数量并改变肿瘤微环境使其更好地发挥功能哪个,从而改善对肿瘤的更好地控制。
这种名为SNAPvax的实验性疫苗是由研究者Robert Seder等人设计开发的,目前研究人员计划在2023年推动SNAPvax疫苗平台用于治疗人类乳头瘤病毒相关的癌症。综上,本文研究结果表明,肿瘤特异性CD8+ T细胞的产生以及与肿瘤微环境重塑相结合或许有望作为一种抵御肿瘤免疫疗法的新方法。
【3】The Lancet Infect Dis:首个国产宫颈癌疫苗弯道超车 5.5年随访结果显示保护率100%
Fang-Hui Zhao,Ting Wu,Yue-Mei Hu,et al. Efficacy,safety and immunogenicity of an Escherichia coli-produced Human Papillomavirus (16 and 18) L1 virus-like-particle vaccine: end-of-study analysis of a phase 3,double-blind,randomised,controlled trial,Lancet Infect Dis. 2022 Dec;22(12):1756-1768. doi:10.1016/S1473-3099(22)00435-2
近日,一篇发表在国际杂志The Lancet Infectious Disease上题为“Efficacy, safety, and immunogenicity of an Escherichia coli-produced Human Papillomavirus (16 and 18) L1 virus-like-particle vaccine: end-of-study analysis of a phase 3, double-blind, randomised, controlled trial”的研究报告中,来自中国医学科学院等机构的科学家们通过研究发现,首个国产二价HPV(Human Papilloma Virus,人乳头状瘤病毒)疫苗馨可宁的5.5年随访结果。研究结果显示:馨可宁在18至45岁女性符合方案人群中,预防HPV16/18型相关高级别生殖器癌前病变终点的保护率高达100%,并可诱导高水平抗体。
在符合方案集人群中,馨可宁对HPV16/18型感染相关的高级别生殖器病变终点保护率为100%(95%置信区间:67.2%-100.0%);对HPV16/18型持续性感染(6个月)的保护率为97.3%(95%置信区间:89.9%-99.7%)。在66个月随访分析中,馨可宁疫苗可有效诱导受试者产生较高且长期保持的HPV 16型及18型中和抗体和IgG抗体水平,表现出良好的免疫持久性。这项研究的随访时间超过了其他国产HPV疫苗,作为首个国产HPV疫苗,馨可宁的保护效果经过了更长时间的验证。
万泰馨可宁于2019年12月获批上市。在保护率方面,根据临床试验分析报告,在预防HPV16/18型相关癌前病变这项指标上,葛兰素史克二价疫苗保护率(95%置信区间)达到87.3%(5.3-99.7),默沙东四价疫苗达到100%(32.3-100),馨可宁达到100%(55.6-100);在预防HPV16/18型6个月持续性感染的效力上,馨可宁疫苗保护率达到97.8%(95%置信区间87.1-99.9),葛兰素史克二价疫苗保护率96.3%,默沙东四价疫苗保护率75.9%。此外,研究期间未发生任何与疫苗接种相关的严重不良事件。结果显示,试验组、对照组严重不良事件的发生率相似(疫苗组3691名参与者中267名[7.2%])和对照组3681名参与者中290名[7.9%]),且所有严重不良事件均与疫苗接种无关。
【4】Adv Mater:中国科学家在肿瘤纳米疫苗开发中取得新突破
Jie Zhang,Biao Fan,Guoliang Cao,et al. Direct Presentation of Tumor-Associated Antigens to Induce Adaptive Immunity by Personalized Dendritic Cell-Mimicking Nanovaccines,Adv Mater. 2022 Nov;34(47):e2205950. doi:10.1002/adma.202205950.
肿瘤疫苗是指利用肿瘤抗原,通过主动免疫方式诱导机体产生特异性抗肿瘤效应,激发机体自身的免疫保护机制,达到治疗肿瘤或预防肿瘤发生的作用。尽管基于疫苗的抗肿瘤疗法有优越的理论基础,但目前未能达到令人满意的临床治疗效果。其中,提高疫苗的免疫刺激效率是肿瘤免疫治疗领域的重要研究方向之一。
近日,一篇发表在国际杂志Advanced Material上题为“Direct Presentation of Tumor-Associated Antigens to Induce Adaptive Immunity by Personalized Dendritic Cell-Mimicking Nanovaccines”的研究报告中,来自中国科学院国家纳米科学中心的科学家们通过研究构建了一种高效、可直接呈递主要组织相容性复合体(MHC)-肿瘤抗原给T细胞的纳米树突状细胞疫苗。
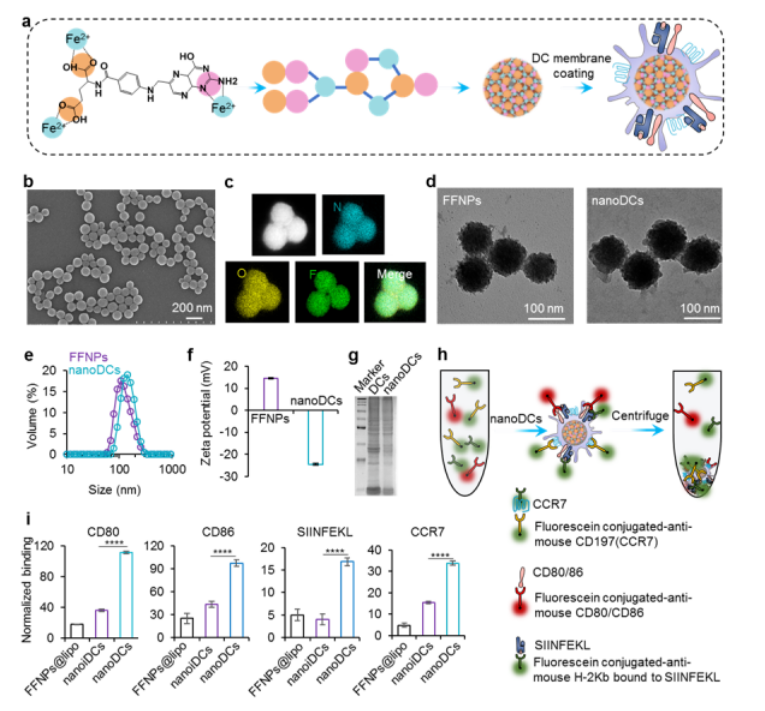
图片来源:Adv Mater. 2022 Nov;34(47):e2205950. doi:10.1002/adma.202205950.
该研究通过体外控制刺激条件的方式,将小鼠体内提取并诱导出的骨髓来源树突状细胞(BMDCs)和肿瘤细胞-细菌融合材料共孵育,以此得到包含MHC-肿瘤抗原复合物的个性化树突状细胞疫苗。研究将提取包含有个性化MHC-肿瘤抗原复合体和共刺激因子(CD80/86)的细胞膜包覆在叶酸-铁离子自组装的树突状纳米颗粒上,以此构建得到可直接刺激T细胞诱导特异性肿瘤免疫反应的纳米树突状细胞疫苗。
实验结果表明,该纳米树突状细胞呈现显著淋巴结归巢能力和诱导特异性细胞免疫效果,在体内有效抑制了肿瘤生长和转移灶形成,且诱导了记忆T细胞的长期免疫保护,有望用于个性化肿瘤免疫治疗。
【5】Nat Commun:中国科学家开发出基于纳米技术的原位癌症疫苗 可激活全身免疫反应
Yuxin Guo,Shao-Zhe Wang,Xinping Zhang, et al. In situ generation of micrometer-sized tumor cell-derived vesicles as autologous cancer vaccines for boosting systemic immune responses,Nat Commun. 2022 Nov 1;13(1):6534. doi:10.1038/s41467-022-33831-7.
在过去的十年中,癌症免疫疗法在癌症治疗中显示出巨大的前景。各种癌症免疫疗法,例如免疫检查点阻断疗法、癌症疫苗、CAR-T疗法等,已被广泛研究并取得了理想的结果。其中,癌症疫苗能引起肿瘤特异性免疫刺激,是最重要的免疫治疗策略之一,在癌症治疗中具有巨大潜力。基于新抗原(Neoantigen)和信使RNA(mRNA)的癌症疫苗在患者中取得了令人鼓舞的结果。尽管在癌症疫苗的研发上做出了巨大的努力,但目前仍处于癌症预防阶段,在癌症患者中引起大量免疫反应仍然是一个巨大挑战,这主要是由于这些癌症疫苗的免疫原性较弱、免疫抑制肿瘤微环境,以及癌症疫苗中的抗原与特定患者肿瘤之间的地相关性。
近日,一篇发表在国际杂志Nature Communications上题为“In situ generation of micrometer-sized tumor cell-derived vesicles as autologous cancer vaccines for boosting systemic immune responses的研究报告中,来自东南大学等机构的科学家们通过研究开发出基于纳米技术的原位癌症疫苗,其或能有效激活全身的免疫反应。
文章中,研究者开发了负载了阿霉素(DOX)、酪氨酸激酶抑制剂(TKI)和透明质酸(HA)包被的树枝状聚合物(Dendritic Polymers)组成的纳米颗粒——HDDT纳米颗粒,HDDT纳米颗粒可以将各种癌细胞100%转化为微米尺寸的囊泡(HMVs)。肿瘤小鼠模型实验显示,HDDT纳米颗粒能够抑制肿瘤生长,诱导强大的免疫原性细胞死亡,并通过原位生产HMVs将原发肿瘤转化为抗原库,作为癌症免疫治疗的个性化癌症疫苗。此外,HDDT纳米颗粒治疗后肿瘤模型小鼠表现出较强的免疫记忆效应,可长期防止肿瘤复发。
在这项研究中,研究团队制作了一系列纳米炸弹(Nanobombs,NBs),包括负载阿霉素(DOX,抗癌药物)和酪氨酸激酶抑制剂(TKI,抗癌药物)和透明质酸(HA,用于肿瘤靶向)包被的树枝状聚合物( Dendritic Polymers),称为HDDT NBs。研究团队发现,在HDDT NBs处理癌细胞后,几乎所有的细胞(直径10-30微米)都转变为均匀的微米尺寸的囊泡(1.6-3.2微米),细胞到囊泡的转化效率高达100%,也就是所有癌细胞都可以有效地转化为HDDT诱导的微米尺寸的囊泡(HMVs)。
【6】JAMA Oncol:一种新型的实验性疫苗有望让乳腺癌患者的十年生存率达到80%
Mary L Nora Disis,Katherine A Guthrie,Ying Liu,et al. Safety and Outcomes of a Plasmid DNA Vaccine Encoding the ERBB2 Intracellular Domain in Patients With Advanced-Stage ERBB2-Positive Breast Cancer:A Phase 1 Nonrandomized Clinical Trial,JAMA Oncol.2022 Nov 3;e225143. doi:10.1001/jamaoncol.2022.5143.
目前,乳腺癌是全球及中国女性发病率最高的恶性肿瘤之一。2020年全球最新癌症负担报告显示,2020年全球乳腺癌新发病例226万,超越肺癌成为全球第一大癌症。我国由于人口基数大,整体乳腺癌防治形势都更为严峻,每年新发病例数量约40-42万,发病率以2%-4%的幅度增长。当下,积极探索乳腺癌的有效治疗方案是控制这一形势的重中之重。
近日,一篇发表在国际杂志JAMA Oncology上题为“Safety and Outcomes of a Plasmid DNA Vaccine Encoding the ERBB2 Intracellular Domain in Patients With Advanced-Stage ERBB2-Positive Breast Cancer: A Phase 1 Nonrandomized Clinical Trial”的研究报告中,来自华盛顿大学医学院的科学家通过研究报告了一种针对乳腺癌的实验性疫苗对一种关键的肿瘤蛋白人表皮生长因子受体2(HER2)产生了强烈的免疫反应,该疫苗或能治疗不同类型的乳腺癌。研究表明,疫苗成功地刺激了所需的细胞毒性免疫反应,同时不会引发严重的副作用,说明疫苗是安全且有效的。
正常情况下,HER2存在于人体很多细胞表面,但在30%左右的乳腺癌中,HER2出现过表达现象,其过表达量是正常细胞中HER2表达量的数百倍。HER2阳性乳腺癌恶性程度高、侵袭性强,治疗后也更容易复发,但同时HER2的过度表达也可能会引发有益的免疫反应。比如,HER2阳性乳腺癌患者如果产生一种称为细胞毒性或细胞杀伤性的免疫反应,其经过治疗后出现癌症复发的可能性较小,总生存期也长于没有产生此种免疫反应的患者。
为了促进这种免疫反应的发生,研究人员创造了一种DNA疫苗,该疫苗包含目标蛋白质的DNA指令,在注射疫苗后,该DNA会被注射部位的细胞吸收,接着会产生疫苗DNA指令中编码的蛋白质。然后,细胞会将蛋白质呈递给免疫系统,这一过程可能会产生强烈的细胞毒性免疫反应。这项研究就旨在评估这种针对HER2的乳腺癌疫苗的安全性和免疫原性,研究共纳入66名晚期HER2阳性乳腺癌患者。患者被依次纳入3个剂量组,分别为低剂量组(10 mcg)、中等剂量组(100 mcg)、高剂量组(500 mcg),每位患者均接受3针疫苗注射。此外,患者还接受了免疫刺激药物粒细胞——巨噬细胞集落刺激因子,进而促进细胞毒性免疫。
【7】BMJ:宫颈癌前病变患者也能打HPV疫苗 可降低术后宫颈癌前病变的复发风险
Konstantinos S Kechagias,Ilkka Kalliala,Sarah J Bowden, et al. Role of human papillomavirus (HPV) vaccination on HPV infection and recurrence of HPV related disease after local surgical treatment:systematic review and meta-analysis,BMJ. 2022 Aug 3;378:e070135. doi: 10.1136/bmj-2022-070135.
人乳头瘤病毒(human papillomavirus,HPV)疫苗在国内上市以来一直供不应求,是网红疫苗无疑了。身边的女性朋友几乎没有不知道这个疫苗的,见面聚会时常常还会问问彼此,你接种了吗?但有的朋友一直没有接种HPV疫苗,原因是已经感染HPV并有宫颈病变了,她们不知道打HPV疫苗还有用吗?
近日,一篇发表在国际杂志BMJ上题为“Role of human papillomavirus (HPV) vaccination on HPV infection and recurrence of HPV related disease after local surgical treatment: systematic review and meta-analysis”的研究报告中,来自英国帝国理工学院医学院等机构的科学家们通过进行一项荟萃分析为上面的问题提供了参考答案。在这项分析中,他们发现对于HPV感染并出现2+级别宫颈上皮内瘤变(CIN)且接受了手术治疗的患者来说,手术后接种HPV疫苗与复发风险降低57%有关。尤其当感染的HPV是16和18两种高危型别时,复发风险可降低74%。
同时,消除宫颈癌的另一个重要手段是宫颈癌前病变的早发现早治疗。宫颈癌前病变即CIN,可分为轻度(CIN1)、中度(CIN2)或重度(CIN3)。在临床上,中度以上的CIN也被称为高级别CIN。CIN1大多数会自然消退,观察随访即可;但CIN2+有发展为宫颈癌的可能,则需要手术治疗,而且这部分患者是HPV易感人群,即使经过手术治疗,也很容易再次感染。虽然相比低年龄段,在26岁之后接种HPV疫苗成本高而收益低,但对于这部分HPV易感女性人群来说,接种HPV疫苗很可能降低宫颈癌发生的风险。
在本项荟萃分析中,研究者们利用16项随机对照试验和观察性研究开展主要结果分析,利用4项随机对照试验事后分析进行次要结果分析。主要分析结果显示,与未接种HPV疫苗相比,手术时接种疫苗与女性患者CIN2+复发风险降低57%有关(11项研究,19009名参与者,中位随访时间为36个月)。此外,手术时接种HPV疫苗,与女性患者CIN3复发风险降低72%有关(疫苗接种情况存疑,3项研究,17757名参与者)。
【8】Nat Med:在临床试验中黑猩猩腺病毒联合自扩增mRNA癌症疫苗或能延长晚期实体瘤患者的总生存期
Christine D Palmer,Amy R Rappaport,Matthew J Davis,et al. Individualized,heterologous chimpanzee adenovirus and self-amplifying mRNA neoantigen vaccine for advanced metastatic solid tumors:phase 1 trial interim results,Nat Med. 2022 Aug;28(8):1619-1629. doi: 10.1038/s41591-022-01937-6.
随着生物学和医学的发展,人类对癌症以及自身免疫系统的认知愈渐加深,科学家们也意识到免疫系统才是对抗癌症最具杀伤力的武器。基于此,近些年来,癌症免疫疗法逐渐兴起并不断完善。如今,癌症免疫疗法在利用免疫系统靶向和摧毁癌症方面已展现出良好的前景,使突变负担高的癌症患者获益。多项研究表明,靶向肿瘤新抗原的细胞毒性CD8+T细胞对免疫检查点抑制疗法(CPI)的肿瘤控制和清除至关重要。因此,如果能扩大预先存在的肿瘤特异性T细胞的数量,无疑能大大增强了CPI疗法的治疗效果。
近日,一篇发表在国际杂志Nature Medicine上题为“Individualized, heterologous chimpanzee adenovirus and self-amplifying mRNA neoantigen vaccine for advanced metastatic solid tumors: phase 1 trial interim results”的研究报告中,来自美国的科学家们通过进行一项1/2期临床研究(NCT03639714),结果表明,以个性化、异源黑猩猩腺病毒(ChAd68)和自扩增mRNA(samRNA)为基础的新抗原疫苗,可以诱导强烈、持久且有效的肿瘤新抗原特异性CD4+和CD8+T细胞应答,增强免疫检查点抑制剂的疗效,在晚期转移性实体瘤患者的治疗中表现优异。目前,该临床试验已经推进到2/3期。

新型疫苗可诱导NHPs中广泛、持久的CD8+T细胞应答
图片来源:Nat Med. 2022 Aug;28(8):1619-1629. doi:10.1038/s41591-022-01937-6.
在这项最新研究中,研究团队以个性化、异源黑猩猩腺病毒(ChAd68)和委内瑞拉马脑炎病毒samRNA载体为基础的新抗原疫苗作为主要研究端点,评估其安全性和耐受性等指标。研究对象为非人灵长类动物,以及联合纳武单抗(Nivolumab,抗PD-1单抗)和伊匹单抗(Ipilimumab,抗CTLA-4单抗)的晚期转移性实体瘤患者。
在非人灵长类动物(NHP)实验中,研究团队评估了针对猿类免疫缺陷病毒(SIV)模型抗原的免疫应答的效力和寿命,以及皮下注射抗CTLA-4单抗的影响。他们发现,异源疫苗接种可在NHP中诱导广泛、持久的CD8+T细胞应答,这些应答可长期检测到,并可在2年后仍持续提高。
在晚期转移性实体瘤患者中,研究团队评估了针对个性化预测的癌症新抗原的免疫原性,以及深入分析异源疫苗方案引起的T细胞反应。首次在人体中的数据显示,该疫苗方案是安全的,并诱导CD8+T细胞对预测的患者特异性癌症新抗原反应。
【9】J Extracell Vesicles:中国科学家开发出嵌合RNA外泌体疫苗 有望治疗突变非依赖肿瘤
Xiao Xiong,Xiurong Ke,Lu Wang,et al. Neoantigen-based cancer vaccination using chimeric RNA-loaded dendritic cell-derived extracellular vesicles,J Extracell Vesicles. 2022 Aug;11(8):e12243. doi:10.1002/jev2.12243.
基因突变是重要的肿瘤发病机制也是目前多数靶向治疗的用药指征,但在很多肿瘤中这些靶点突变很低或者缺乏,现有靶向药物难有用武之地。以我国高发的恶性消化道肿瘤食管癌为例,临床上检测不到有效的基因突变并缺乏针对性的靶向药物,近年来测序研究发现食管等正常组织体细胞存在高频度的基因突变,包括诸多肿瘤驱动基因的突变,比如正常食管组织的NOTCH1突变比食管癌组织高出数倍。针对大量存在的“突变非依赖肿瘤”,暨南大学张灏团队以食管癌为模型寻找突变之外的靶点,由此发现了RNA异常剪接产生的嵌合RNA。通过多维筛选,找出了一批肿瘤特异性的嵌合RNA,并发现了嵌合RNA翻译产生的嵌合蛋白。其中A-Pas是RNA异常剪接过程中由内含子反义链剪接成的肿瘤特异性嵌合产物,在食管癌发生和转移起驱动作用,并和肿瘤免疫相关,具有治疗靶点和新生抗原的价值。
近日,一篇发表在国际杂志Journal Extracellular Vesicles上题为“Neoantigen-based cancer vaccination using chimeric RNA-loaded dendritic cell-derived extracellular vesicles”的研究报告中,来自中国暨南大学的科学家们通过研究发现,嵌合RNA或能作为肿瘤新抗原来帮助研制嵌合RNA外泌体疫苗,同时研究人员还开展了食管癌免疫治疗的实验研究。
研究团队在前期建立的外泌体技术平台基础上,以A-Pas为新抗原,应用DC来源外泌体研发了嵌合RNA外泌体疫苗。体外实验证明A-Pas促进DC成熟并升高T细胞的特异性性杀伤能力。在动物模型体内实验中发现嵌合RNA外泌体疫苗可有效地抑制肿瘤生长并显著地延长了荷瘤小鼠的生存时间。进一步研究发现嵌合RNA外泌体疫苗通过刺激先天免疫和获得性免疫重塑了肿瘤免疫微环境,并通过 CD8 T细胞依赖机制发挥免疫治疗作用。
研究人员长期以来开展RNA异常剪接及其嵌合产物在肿瘤发生演化中的机制研究和诊断治疗转化。课题组此前还研发了嵌合RNA唾液外泌体液体活检,制备了嵌合RNA翻译蛋白的单克隆抗体和嵌合RNA 条件性基因敲入小鼠模型,嵌合RNA外泌体疫苗为治疗包括食管癌在内的“突变非依赖肿瘤”提供了新的方案。
【10】Nature:科学家开发出有望克服癌变肿瘤免疫防御的新型疫苗
Badrinath,S.,Dellacherie,M.O., Li,A. et al. A vaccine targeting resistant tumours by dual T cell plus NK cell attack. Nature (2022). doi:10.1038/s41586-022-04772-4
大多数的癌症疫苗能靶向作用肽类抗原,由于向T细胞呈递肽的主要组织相容性复合物(MHC)分子存在巨大的个体差异,因此研究人员有必要进行个性化的定制,此外,肿瘤能通过干预肽类呈递的机制来频繁躲避T细胞介导的免疫力。近日,一篇发表在国际杂志Nature上题为“A vaccine targeting resistant tumours by dual T cell plus NK cell attack”的研究报告中,来自美国、日本等多个国家的研究人员通过研究开发出了一种新型疫苗,其或能通过克服肿瘤的防御系统来帮助宿主机体免疫系统破坏癌变的肿瘤,文章中,研究人员描述了这类新型疫苗以及其如何在小鼠和猕猴模型中发挥作用的。
直到最近,能帮助临床医生治疗癌症患者的唯一可用工具就是化疗、放疗和外科手术,近日,研究人员正在开发新型疫苗来抵御癌症,比如,抵御HPV相关疾病的新型疫苗或许就能降低人类患宫颈癌和其它类型癌症的风险,其它的研究工作则涉及靶向作用肽类抗原,且被证明是有效的,但只有是在非常有限的情况下。这项研究中,研究人员开发了一种更为普遍的疫苗,他们认为这种疫苗能帮助多种类型癌症患者抵御多种癌症。
这种新型疫苗能通过剥夺肿瘤所使用的主要防御性策略的一种来发挥作用,即从其表面裂解T细胞核自然杀伤性细胞,当机体检测到一种正在生长的肿瘤并提醒宿主机体的免疫系统时,就回招募这类细胞。通过在其表面贴上MICA和MICB蛋白后再使其脱落,肿瘤就能自由生长,这类新型疫苗能通过干预整个裂解过程来发挥作用,从而预防肿瘤细胞脱落并杀死免疫细胞,新型疫苗还能通过增加肿瘤细胞表面的蛋白密度来破坏这一裂解过程,因此研究人员将其描述为“煽动性保护性免疫”(inciting protective immunity)。
综上,本文研究结果表明,这种新型疫苗在一种重要的临床环境中是非常有效的,在术后切除高度转移的原发性肿瘤后进行免疫,或能抑制随后转移性癌症的生长,这种疫苗的设计甚至还能促使机体的保护性免疫抵御具有常见逃逸突变的肿瘤类型。
【11】Nat Biomed Eng:中国科学家在口服肿瘤疫苗研究中取得进展
Yale Yue,Jiaqi Xu,Yao Li,et al. Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria,Nat Biomed Eng. 2022 Jul;6(7):898-909. doi:10.1038/s41551-022-00886-2.
近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria”的研究报告中,来自中国科学院国家纳米科学中心的科学家们在人类口服肿瘤疫苗方面取得重要研究进展。
作为体内最大的免疫器官,肠道内分布着机体70%-80%的免疫细胞,因此相比于常规的注射类疫苗,口服疫苗有望通过刺激肠道内丰富的免疫细胞,从而激活免疫反应来预防和治疗疾病。此外,口服疫苗具有更好的患者依从性和更低的应用成本。然而,严苛的消化道环境和复杂的肠道上皮屏障是口服疫苗面临的主要挑战;尽管有如脊髓灰质炎等基于减毒活疫苗技术的口服疫苗成功用于传染病防治,但通用的可设计抗原的口服疫苗体系仍十分有限。
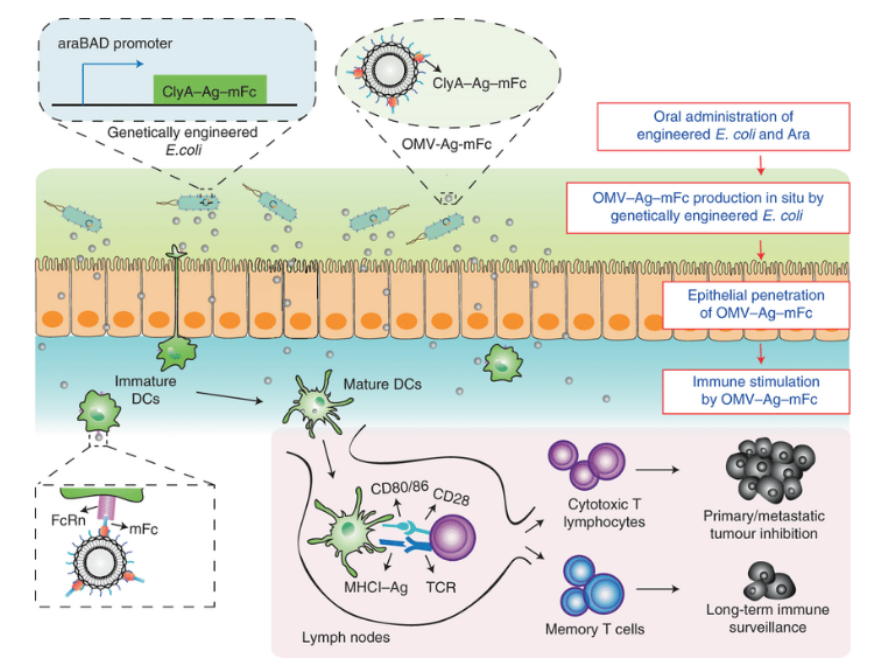
图片来源:Nat Biomed Eng. 2022 Jul;6(7):898-909. doi:10.1038/s41551-022-00886-2.
研究人员长期致力于疫苗体系的开发,特别是基于细菌外膜囊泡(outer membrane vesicles,OMVs)的疫苗体系研究。在前期研究中,科研人员利用基因工程技术、多肽分子胶水技术以及RNA结合蛋白技术,分别构建了可快速展示多肽抗原或mRNA抗原的“即插即用”式OMV肿瘤疫苗载体;通过基因工程技术和载体表面工程改造,构建了DC细胞摄取增强型OMV疫苗载体以及携带PD1免疫检查点抑制剂的OMV疫苗载体,借助点击化学原理,设计了可主动捕获肿瘤抗原的原位OMV肿瘤疫苗。
在前期工作基础上,科研人员设计了一种基于在体工作细菌机器人的口服疫苗体系,并负载了肿瘤特异性抗原用于肿瘤的预防和治疗。该口服疫苗体系通过控制基因工程细菌在肠道内原位生产携带抗原的细菌外膜囊泡来实现免疫刺激。研究首先通过基因工程将肿瘤抗原融合表达在OMVs的表面,使这种基因工程改造的细菌机器人能够在阿拉伯糖的诱导下分泌带有肿瘤抗原的OMVs。该细菌机器人在口服后能够克服严苛的消化道环境抵达肠道,此时通过口服阿拉伯糖能够诱导细菌机器人在肠道内原位生产携带有肿瘤抗原的OMVs。作为肠道菌群与机体免疫系统相互作用的天然媒介,OMVs可以有效穿透肠道黏液层和肠上皮屏障并被固有层中的抗原递呈细胞摄取,最终在多种临床前肿瘤模型中激活强烈的抗肿瘤免疫反应和免疫记忆效应。综上,该团队建立了一种基于在体工作细菌机器人的口服疫苗体系,通过负载肿瘤抗原能够高效激活适应性抗肿瘤免疫应答;该体系将推进口服疫苗的开发,提高疫苗依从性并降低成本,在未来研究中根据需要也可用于传染病防治。
【12】Nat Nanotechnol:中国科学家开发出新型纳米囊泡疫苗平台,可介导超强抗肿瘤免疫活性
Chao Liu,Xue Liu,Xinchu Xiang, et al. A nanovaccine for antigen self-presentation and immunosuppression reversal as a personalized cancer immunotherapy strategy,Nat Nanotechnol
. 2022 May;17(5):531-540. doi: 10.1038/s41565-022-01098-0.
恶性肿瘤严重威胁人类健康,免疫疗法的探索与发展旨在为肿瘤治愈寻求新突破。抗肿瘤免疫的成功建立需要抗原特异性淋巴细胞的激活、扩增及分化。这一过程在很大程度上取决于 T 细胞和抗原递呈细胞(APC)之间的相互作用。但现有肿瘤疫苗如新抗原疫苗及各种载体疫苗均依赖于在机体内与宿主 APC 的随机接触,不适当的接触可能导致免疫应答的沉默;同时,CD8+ T细胞的活化过度依赖于抗原交叉递呈,该递呈方式机制复杂且效率不高。此外,在肿瘤免疫微环境中,抗原特异性 CTL 应答常常受到免疫检查点的抑制。尽管基于免疫检查点的免疫疗法已被证明具有巨大的潜力,但只有小部分患者对该疗法完全响应,相关分子机制也需进一步深入探索。
近日,一篇发表在国际杂志Nature Nanotechnology上题为“A nanovaccine for antigen self-presentation andimmunosuppression reversal as a personalized cancer immunotherapy strategy”的研究报告中,来自厦门大学等机构的科学家们通过研究发现了共刺激信号对肿瘤免疫耐受中T细胞功能重塑的重要机制,并首次报道了一种既可直接激活初始 T 细胞,又可活化耗竭性 T 细胞的仿生细胞膜囊泡抗肿瘤疫苗策略,为个性化肿瘤疫苗研发提供了理论依据和创新方法。
在这项工作中,研究人员创建的细胞膜仿生定向表达展示技术,将工程化树突状细胞(DCs)膜作为一种天然的免疫活化信号转导载体,调控树突状细胞表面共刺激分子表达,构建了ASPIRE纳米囊泡疫苗平台,通过多重共刺激信号递送实现多维度的抗肿瘤免疫活化。制备的 ASPIRE 疫苗体系,因为其来源于树突状细胞母细胞表面与归巢效应相关的功能性趋化因子和粘附分子,以及可控的纳米尺寸,所以能迅速穿越组织间隙,实现在淋巴结的富集,并介导 CD8+T 细胞主导的抗原特异性免疫应答。有别于传统的疫苗递呈方式,研究中所制备的疫苗可以直接将表位递呈至 T 细胞,且不需要体内的抗原递呈细胞的参与。这种抗原递呈模式很大程度提高了免疫活化的效率。该疫苗即使在实体瘤的治疗中也发挥了非常强劲的效果,实现对实体肿瘤的彻底清除,并诱导长效的免疫记忆。
综上,本文研究描述了一种既可激活初始 T 细胞,又可活化耗竭性 T 细胞的新型疫苗策略,并通过抗肿瘤动物实验验证了 ASPIRE 介导的超强抗肿瘤免疫活性。
【13】Structure:蜘蛛丝增强p53抗癌能力 有望开发出广谱mRNA癌症疫苗
Margit Kaldmae,Thibault Vosselman,Xueying Zhong,et al. A “spindle and thread” mechanism unblocks p53 translation by modulating N-terminal disorder,Structure (2022) doi:10.1016/j.str.2022.02.013
p53是一个拥有广泛而强大功能的抑癌基因,超过一半的肿瘤患者带有p53基因突变。p53基因突变是肿瘤发生、发展、治疗耐药性和预后不良的重要驱动力。在细胞中,p53能够修复DNA损伤,阻止具有突变或损伤DNA的细胞分裂等功能,从而阻止癌症的发生发展。然而,p53在体内的表达量低,而且其蛋白在细胞中会被迅速分解,因此,如果能稳定地增加p53水平,有望开发出新的癌症治疗方法。
近日,一篇发表在国际杂志Structure上题为“A “spindle and thread” mechanism unblocks p53 translation by modulating N-terminal disorder”的研究报告中,来自瑞典卡罗林斯卡学院的科学家们通过研究发现,蜘蛛丝或能增强p53的抗癌能力,有望帮助开发出广谱的mRNA癌症疫苗。
文章中,研究人员将p53蛋白与天然的高度稳定的蜘蛛丝蛋白的N端结构域融合,构建了一种高表达的、结构更稳定的融合p53蛋白,该蛋白在人类癌细胞中具有完全的生理活性。研究团队表示,希望基于这一发现最终开发出一款mRNA癌症疫苗,治疗p53基因突变相关的癌症;使用电子显微镜、计算机模拟和质谱分析,研究团队证实融合蛋白形成了一个紧凑的稳定构象,p53蛋白的无序反式激活域被包裹在了蜘蛛丝蛋白N端结构域周围。
这项研究表明,p53蛋白与蜘蛛丝蛋白N端结构域的融合,有助于增加p53蛋白的翻译水平,并通过形成更致密的结构来增加p53蛋白的稳定性,而且融合蛋白在人类癌细胞中具有完全的生理活性。研究者指出,这项研究证实了减少N端无序可以克服p53翻译效率低下的问题,从而产生构象稳定且具有生物活性的蛋白;这项研究中融合蛋白是直接通过合成的mRNA表达而来,研究团队表示,在细胞中创造一种更稳定的p53突变蛋白是一种很有前景的癌症治疗方法,希望最终能开发出一款基于mRNA的癌症疫苗。当然,目前还需要进一步验证这种融合的p53蛋白在细胞中将被如何处理,以及剂量毒性问题。
【14】Nat Biomed Eng:科学家有望改造细菌作为癌症疫苗
Wenguang Wang,Haiheng Xu,Qingsong Ye,et al. Systemic immune responses to irradiated tumours via the transport of antigens to the tumour periphery by injected flagellate bacteria,Nat Biomed Eng. 2022 Jan;6(1):44-53. doi:10.1038/s41551-021-00834-6.
尝试利用自身免疫系统攻击肿瘤细胞是一种最理想的抗肿瘤治疗方式。肿瘤接受了放疗以后,会释放出一系列的抗原。理想状态下,这些抗原可以直接作为抗肿瘤原位疫苗,激活树突状细胞(DC),然后将抗原呈递给CD4+T或者CD8+T细胞,从而启动免疫反应。然而,由于肿瘤在其内部构建了一种抑制性的免疫微环境,导致放疗诱导细胞释放抗原的同时,也会诱导抑制性免疫细胞的浸润。在这些免疫抑制细胞的作用下,DC变成功能失常的DC,它们的作用不再是刺激T细胞的增殖,而是加剧Treg细胞的增殖,并不断增强肿瘤的免疫抑制微环境。
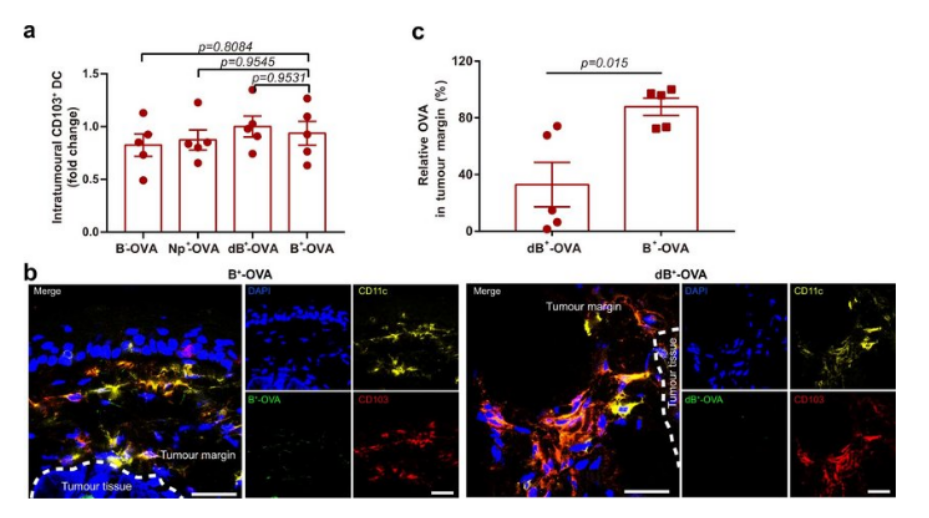
图片来源:Nat Biomed Eng. 2022 Jan;6(1):44-53. doi:10.1038/s41551-021-00834-6.
近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Systemic immune responses to irradiated tumours via the transport of antigens to the tumour periphery by injected flagellate bacteria”的研究报告中,来自南京大学的科学家们通过研究发现,肿瘤放疗之后,在瘤内注射阳离子修饰的减毒沙门氏菌,可以增加肿瘤抗原在肿瘤周围的富集,并增加抗原与树突状细胞之间的交流,增加抗肿瘤免疫反应,最终实现减低肿瘤转移和复发的目的,这或许为原位肿瘤疫苗提出了新的策略和思路。
研究者表示,肿瘤内给予GM-CSF和FLT3L可以增加肿瘤内DC细胞的数量,或者给与Toll样受体激动剂增加瘤内DC细胞的功能。然而由于肿瘤内存在的抑制性免疫微环境,招募进入肿瘤内的DC在抑制因子的作用下又重新进入功能失常状态。相比于瘤内抑制性的免疫微环境,在肿瘤周围分布着大量功能正常的DC细胞,尤其是CD103+DC细胞,被认为是抗原转移的最重要的DC亚群。然而由于其距离肿瘤的位置较远,并不能有效地摄取放疗后肿瘤所释放的抗原。
综上,本文研究开创性地提出使用细菌作为肿瘤抗原的运输载体,通过将放疗后肿瘤释放的抗原转运到肿瘤周围,实现了肿瘤免疫反应的增强作用,为原位肿瘤疫苗提出了新的策略和思路。
【15】Mol Cancer:科学家发明了预防肝癌术后复发的个性化疫苗
Zhixiong Cai,Xiaoping Su,Liman Qiu,et al. Personalized neoantigen vaccine prevents postoperative recurrence in hepatocellular carcinoma patients with vascular invasion,Mol Cancer. 2021 Dec 13;20(1):164. doi:10.1186/s12943-021-01467-8.
对恶性肿瘤细胞来说,抗原可以是逃避免疫监视的盔甲,也可以是触发特异性免疫反应的软肋,其中有部分“软肋”的专一性还特别高,不仅能排除免疫系统对正常细胞的误伤,而且也成全了新抗原疫苗的个性化特质,使之有望成为癌症免疫治疗下一个重大的突破口。近日,一篇发表在国际杂志Molecular Cancer上题为“Personalized neoantigen vaccine prevents postoperative recurrence in hepatocellular carcinoma patients with vascular invasion”的研究报告中,来自福建医科大学的科学家们针对基于新抗原的疫苗能否预防肝癌伴血管浸润患者术后复发这一问题开展了研究工作。
他们发现,个性化新抗原疫苗是一种安全、可行、高效的抗肝癌术后复发策略,并且可以通过ctDNA中相应的新抗原突变监测肝癌进展,为肝癌个体化用药提供了可靠的信息检测。该研究共纳入10位HCC伴血管浸润患者,所有入组患者在确诊HCC后均接受根治性手术切除,并在2个月内接受预防性TACE。手术过程中收集肿瘤和瘤周组织进行全外显子组测序,共鉴定出780个非同义体细胞单核苷酸变异,然后通过转录组测序进一步确定了总变异中33.5%的突变表达,并将其确定为新抗原的来源。
根据每位HCC患者的新抗原分析,科学家们合成了6-20条源自体细胞点突变或RNA编辑的新抗原长肽(27aa)用作疫苗,随后将制备的个性化新抗原疫苗与ploy:IC(佐剂)混合,以“启动-加强”的模式注射在HCC患者双侧腋下和腹股沟处进行抗复发治疗。进一步分析发现,与对照组、只接种了启动阶段的疫苗或者对抗原疫苗没有反应的患者相比,接种完全新抗原后且产生免疫反应的患者RFS显着增加(中位RFS: 4.8个月vs 6.7个月vs 19.3个月,P=0.035)。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


