比干细胞移植更便捷!最新研究:牙髓干细胞外泌体破解大脑白质损伤,神经修复有了新靶点
来源:生物谷原创 2025-12-01 14:52
本研究发现,牙髓干细胞来源外泌体可通过肌球蛋白调节轻链9介导蛋白精氨酸甲基转移酶5核定位,下调分化抑制因子2,促进少突胶质前体细胞分化,为缺血性卒中白质修复提供新策略。
缺血性卒中是全球致死致残率最高的神经系统疾病之一,不少患者即便挺过急性期,仍会留下手脚活动不利、记忆力下降等后遗症,影响正常生活。背后关键症结在于缺血导致的大脑白质损伤——这类损伤约占梗死体积的50%,会直接阻碍神经信号传导,成为患者术后恢复的最大障碍。目前针对白质损伤的特异性治疗手段还比较少,而干细胞外泌体因能跨越血脑屏障、储存运输方便等优势,逐渐成为卒中治疗领域的研究重点。
近日,J Cereb Blood Flow Metab发表的一项研究详细解析了牙髓干细胞来源外泌体修复缺血性卒中白质损伤的分子机制,为后续临床转化提供了关键实验依据。

研究团队分别构建小鼠大脑中动脉闭塞模型(模拟体内缺血)和细胞氧糖剥夺/复氧模型(模拟体外缺血),在小鼠缺血再灌注后的第1、3、5天通过脑室内注射牙髓干细胞来源外泌体,随后在第7、14、28天从功能、形态、分子等多维度展开评估。从功能恢复效果来看,接受外泌体处理的小鼠神经功能评分明显降低,转角实验中向健侧转向的次数、足失误实验中的失误步数都有所减少,转棒实验中维持平衡不跌落的时间则显著延长;认知功能上,该组小鼠在Y迷宫中的工作记忆、新物体位置识别实验中的识别记忆也都有明显改善,缺血再灌注引发的空间学习记忆障碍得到有效缓解。
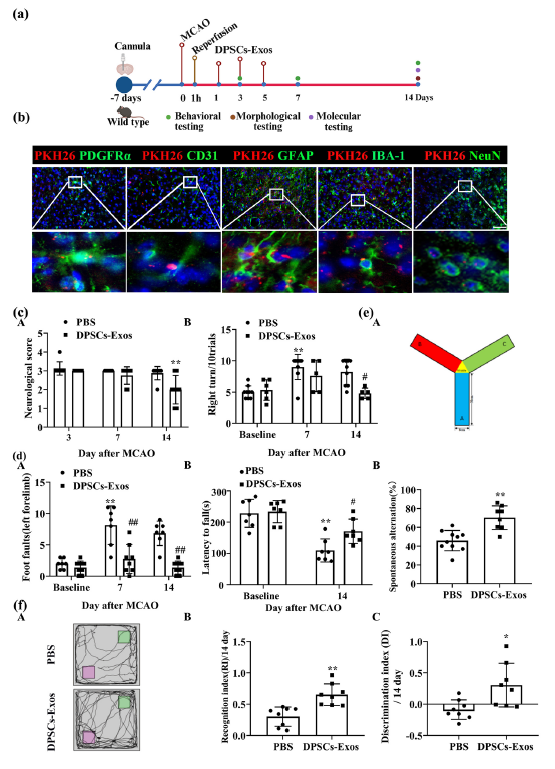
图1:牙髓干细胞来源外泌体(DPSCs-Exos)促进缺血性卒中小鼠感觉运动和认知功能恢复
进一步的形态学观察和分子生物学检测证实,牙髓干细胞来源外泌体确实能促进少突胶质前体细胞分化,同时修复白质完整性。在缺血后的第14天,外泌体处理组小鼠缺血半球的皮质、外囊及纹状体区域,髓鞘标志物髓鞘碱性蛋白(MBP)的表达显著升高,而白质损伤标志物SMI32的表达则明显降低;透射电镜下可见,该组髓鞘化轴突的占比增加、G比值(轴突直径与总纤维直径的比值)降低,Ranvier结的数量也明显增多。免疫染色结果进一步显示,外泌体处理能改善缺血导致的少突胶质前体细胞分化障碍,促进成熟少突胶质细胞生成,体外实验也验证了这一结论,证实该外泌体可直接促进氧糖剥夺/复氧处理后少突胶质前体细胞的增殖与分化。
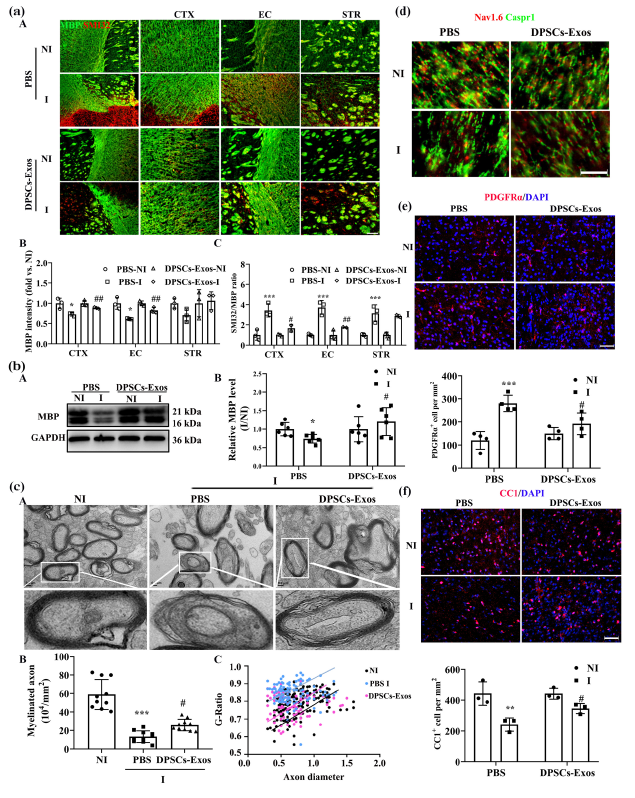
图2:牙髓干细胞来源外泌体(DPSCs-Exos)处理在缺血性卒中后14天增强小鼠少突胶质前体细胞(OPCs)分化并改善白质完整性
在机制解析环节,研究团队发现牙髓干细胞来源外泌体是通过调控PRMT5/ID2轴启动修复过程的。其中,分化抑制因子2(ID2)是少突胶质细胞发育成熟的负向调控因子,外泌体处理能显著降低原代少突胶质前体细胞及小鼠缺血半球中ID2的mRNA和蛋白水平;而蛋白精氨酸甲基转移酶5(PRMT5)是少突胶质前体细胞分化与髓鞘形成的关键分子,外泌体可促进PRMT5进入少突胶质前体细胞的细胞核,缓解缺血再灌注引发的PRMT5表达下调。更关键的是,当特异性敲除少突胶质前体细胞中的PRMT5后,小鼠缺血后的神经功能恢复明显受阻,白质损伤进一步加重,ID2的表达也随之升高,这直接证实PRMT5/ID2轴是外泌体发挥作用的核心通路。
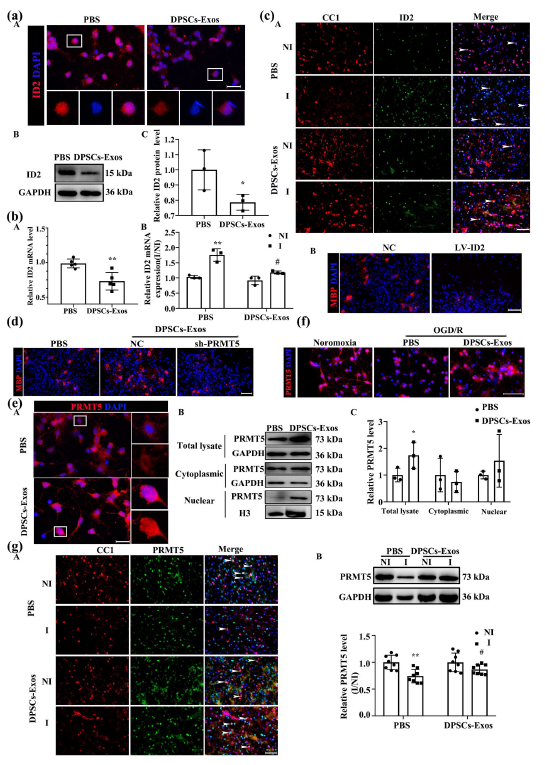
图3:牙髓干细胞来源外泌体(DPSCs-Exos)处理减轻脑缺血后缺血再灌注诱导的分化抑制因子2(ID2)升高和蛋白精氨酸甲基转移酶5(PRMT5)降低
为了找到外泌体中调控PRMT5的关键成分,研究团队通过免疫沉淀联合质谱分析,筛选出与PRMT5相互作用的蛋白,最终锁定了肌球蛋白调节轻链9(Myl9)。实验证实,Myl9能与PRMT5直接结合并促进其进入细胞核;过表达Myl9可显著推动少突胶质前体细胞的增殖与分化,而抑制Myl9则会阻断这一过程,明确了Myl9是外泌体调控PRMT5核定位的关键效应分子。
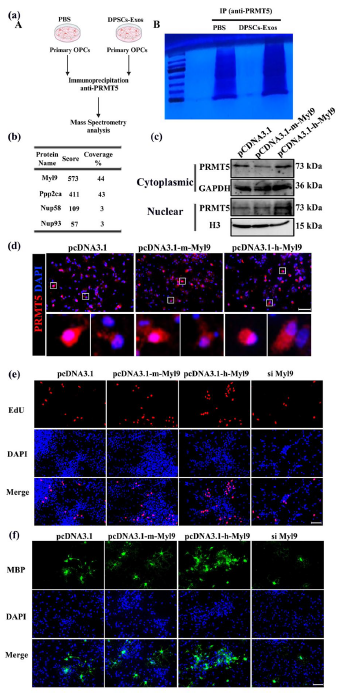
图4:牙髓干细胞来源外泌体(DPSCs-Exos)中的肌球蛋白调节轻链9(Myl9)调控少突胶质前体细胞(OPCs)中蛋白精氨酸甲基转移酶5(PRMT5)的核质分布
综合所有实验结果,研究团队提出了完整的分子机制:牙髓干细胞来源外泌体携带的Myl9进入少突胶质前体细胞后,与PRMT5结合并推动其进入细胞核,通过介导ID2基因的CpG岛甲基化来下调ID2的表达,最终促进少突胶质前体细胞分化为成熟的少突胶质细胞,实现白质修复并改善缺血性卒中后的神经功能。
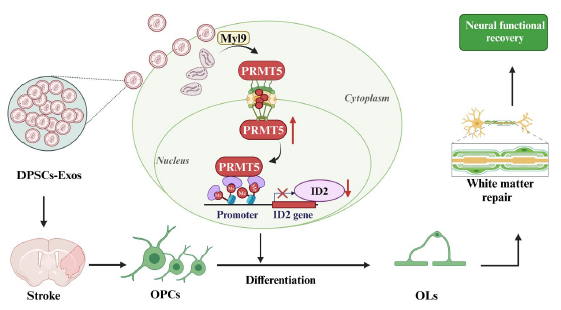
图5:牙髓干细胞来源外泌体(DPSCs-Exos)通过肌球蛋白调节轻链9(Myl9)促进蛋白精氨酸甲基转移酶5(PRMT5)进入少突胶质前体细胞(OPCs)核内,下调分化抑制因子2(ID2)表达,推动OPCs分化、白质修复并改善缺血性卒中后神经功能的分子机制示意图
缺血性卒中后的白质修复一直是临床治疗的难点,这项研究不仅首次揭示了牙髓干细胞来源外泌体通过Myl9-PRMT5-ID2轴调控少突胶质前体细胞分化的新机制,更证实了该外泌体作为缺血性卒中治疗候选方案的潜力。相较于传统干细胞移植,牙髓干细胞来源外泌体在跨越血脑屏障、储存运输等方面的优势,让它更容易向临床转化。随着干细胞外泌体技术的不断成熟,未来这类生物制剂有望为缺血性卒中患者带来新的治疗选择,帮助患者更好地恢复神经功能,减轻疾病对个人和家庭的负担,为卒中治疗领域的发展注入新动力。(生物谷Bioon.com)
参考文献:
Du W, Geng P, Lian Z, et al. DPSCs-Exos promote OPCs differentiation and white matter repair via Myl9-mediated PRMT5 nucleation after ischemic stroke. J Cereb Blood Flow Metab. Published online November 21, 2025. doi:10.1177/0271678X251399014
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


