阵发性夜间血红蛋白尿(PNH)创新疗法!诺华首创补体因子B抑制剂iptacopan:3期临床疗效 优于抗C5疗法!
来源:生物谷原创 2022-10-27 14:05
iptacopan是一款首创的补体系统替代途径抑制剂,有潜力带来第一种口服疗法,改变PNH治疗模式。
图片来源:摄图网
2022年10月24日讯 /生物谷BIOON/ --诺华(Novartis)近日宣布,评估iptacopan(LNP023)治疗阵发性夜间血红蛋白尿(PNH)关键性3期APPLY-PNH试验(NCT04558918)达到了2个主要终点。该试验入组的患者尽管先前接受了抗C5疗法治疗但仍然存在贫血。试验结果显示,口服单药疗法iptacopan(200mg,每日2次)在疗效方面优于抗C5疗法Soliris(eculizumab,依库珠单抗)和Ultomiris(ravulizumab,雷夫利珠单抗)。详细结果将在即将召开的医学会议上公布,并作为2023年全球监管提交文件的一部分。(备注:Soliris和Ultomiris是阿斯利康的2款补体C5抑制剂,Ultomiris是Soliris的长效版,2款药物为PNH的标准护理疗法。)
PNH是一种罕见的、危及生命的血液疾病,特征是补体驱动的溶血、血栓形成和骨髓功能受损,导致贫血、疲劳和其他衰弱症状,这些症状会严重影响患者的生活质量。尽管使用当前的抗C5标准护理疗法进行治疗,很大一部分PNH患者仍然贫血,并依赖输血。
iptacopan是一款首创的(first-in-class)、口服、强效、选择性、小分子、可逆性B因子抑制剂,B因子是补体系统替代途径的关键丝氨酸蛋白酶。iptacopan在C5末段途经的上游发挥作用,不仅可以预防PNH的血管内溶血,还可以预防血管外溶血。通过靶向负责PNH生物学的关键部分,同时提供口服单一治疗选择,iptacopan有潜力具有优于抗C5疗法的治疗优势。
目前,iptacopan正被开发,用于治疗补体系统受累、存在显著未满足需求的一些肾脏疾病,除了PNH之外,还包括IgA肾病(IgAN)、C3肾小球疾病(C3G)、非典型溶血性尿毒症综合征(aHUS)、膜性肾病(MN)。
诺华全球药物开发总裁兼首席医疗官Shreeram Aradhye博士表示:“这些积极的3期研究结果突出表明,对于遭受致衰性贫血以及PNH所致终身输血负担的患者而言,iptacopan具有改变临床实践的潜力。我们期待着与监管机构讨论数据,将这这款首创的替代补体途径抑制剂作为第一种口服单药疗法带给PNH患者群体。”
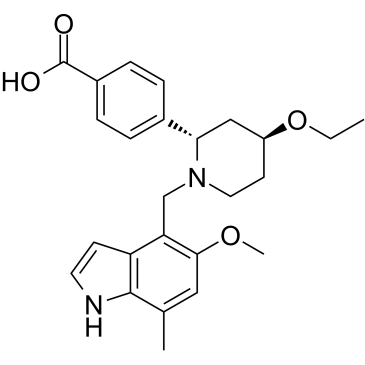
iptacopan化学结构式(图片来源:medchemexpress.com)
APPLY-PNH是一项3期、随机、多国、多中心、阳性对照、开放标签试验,入组的是随机化前最后6个月内尽管接受了稳定的抗C5治疗方案但仍存在残余贫血的PNH成人患者,该试验旨在证明iptacopan单药疗法(200mg,每日口服2次)相对于抗C5疗法Soliris或Ultomiris的优越性。
该试验的一个主要终点是评估治疗24周期间在无需输注红细胞(RBC)的情况下血红蛋白水平从基线水平增加≥2 g/dL的患者比例。另一个主要终点是评估治疗24周期间在无需输注RBC的情况下实现持续血红蛋白水平≥12g/dL患者比例。次要终点包括没有输血的患者百分比、血红蛋白水平的平均变化、疲劳程度的变化、网织红细胞绝对计数的平均变化、乳酸脱氢酶(LDH)水平的平均百分比变化、突破性溶血(breakthrough hemolysis)和主要不良血管事件的发生率。
该试验共入组97名患者,这些患者以8:5的比例随机接受每日2次口服iptacopan单药治疗、或静脉输注抗C5疗法(继续接受与随机化前相同的方案)治疗。
顶线结果显示,该试验达到了2个主要终点:(1)治疗24周期间在无需输注RBC的情况下血红蛋白水平从基线水平增加≥2 g/dL的患者比例,iptacopan治疗组与抗C5疗法治疗组相比有统计学显著和临床意义的增加。(2)治疗24周期间在无需输注RBC的情况下实现持续血红蛋白水平≥12g/dL患者比例,iptacopan治疗组与抗C5疗法治疗组相比也有统计学显著和临床意义的增加。该试验中,iptacopan耐受性良好,安全性良好,与先前报告的数据一致。
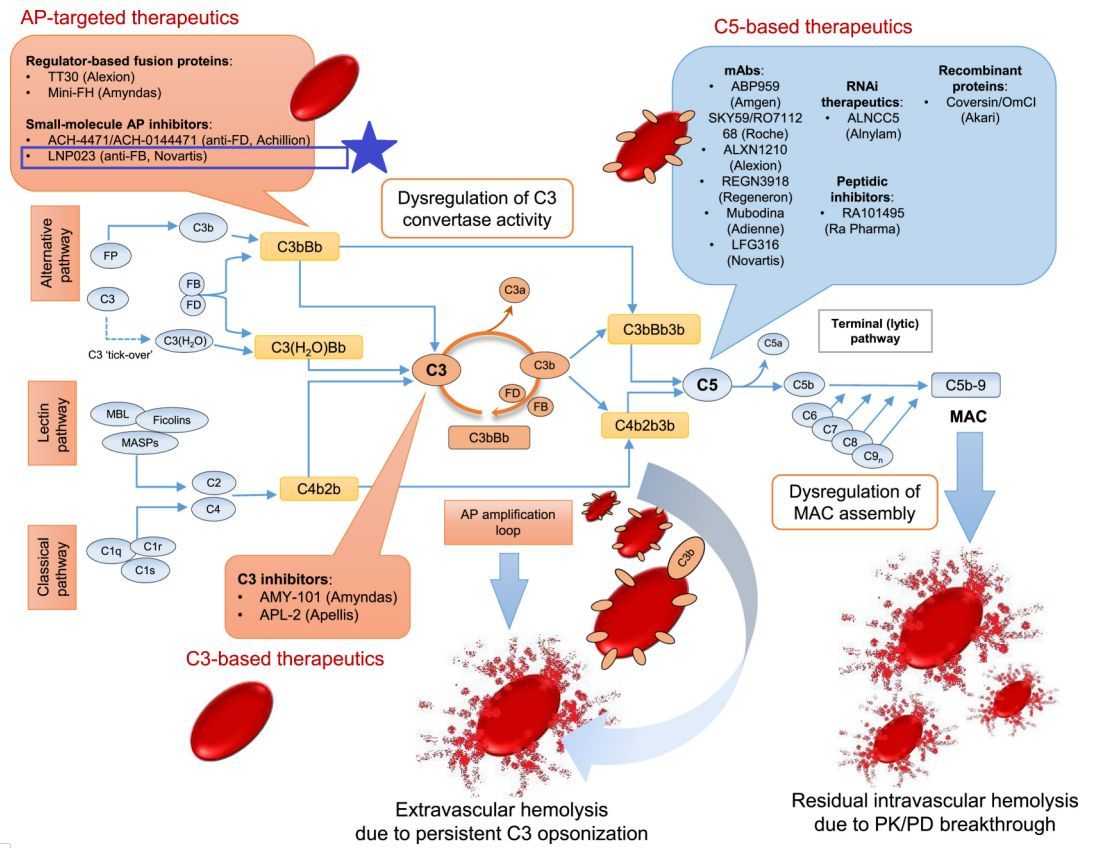
补体激活级联-PNH治疗调制靶点(图片来源于文献:PMC6060635,点击图片查看大图)
iptacopan是诺华肾脏病管线中最先进的资产,其靶标是补体替代途径,这是补体驱动的肾脏疾病(CDRD)的关键驱动因素。此前,iptacopan已获美国FDA和欧盟EMA授予治疗PNH和C3G的孤儿药资格(ODD)、获EMA授予治疗IgAN的ODD、获FDA授予治疗PNH的突破性药物资格(BTD)、获EMA授予治疗C3G的优先药物资格(PRIME)。
除了上述3期APPLY-PNH试验,iptacopan目前也正在3期APPOINT-PNH试验(NCT04820530)中进行评估,用于治疗先前没有接受过补体抑制剂(补体抑制剂初治,naive)的PNH患者,该试验预计将在未来几个月内公布数据。
此外,iptacopan也正在多项3期临床试验中评估,用于治疗补体介导的肾脏疾病(CMKD)C3肾小球疾病(C3G,APPEAR-C3G[NCT04817618])、IgA肾病(IgAN,APPLAUSE-IgAN[NCT05578834])、非典型溶血尿毒症综合征(aHUS,APPELHUS[NCT08989430])。同时,iptacopan也在多个2期临床试验中评估,用于一些其他适应症。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


