MIT团队利用疫苗增强CAR-T疗效,可根除实体瘤,相关管线已进入临床I期
来源:生辉 2023-07-13 17:26
现阶段,CAR-T 细胞疗法在实体瘤中的治疗效果仍然不理想。背后的原因多种多样,包括抗原异质性、免疫抑制性肿瘤微环境、CAR-T 浸润难度大、肿瘤靶抗原丢失......
现阶段,CAR-T 细胞疗法在实体瘤中的治疗效果仍然不理想。背后的原因多种多样,包括抗原异质性、免疫抑制性肿瘤微环境、CAR-T 浸润难度大、肿瘤靶抗原丢失......
其中抗原异质性和肿瘤靶抗原丢失是 CAR-T 治疗实体瘤的两个关键挑战。由于实体瘤中抗原存在异质性,缺乏真正的肿瘤特异性抗原,这极大限制了 CAR-T 的临床效果;靶抗原丢失是研究最为广泛的导致肿瘤细胞逃避 CAR-T 杀伤的一种耐药机制。
近日,MIT 的研究团队提出了一种更高效靶向实体瘤的工程化方法,即开发出了一种疫苗,利用疫苗可增强 CAR- T 细胞对肿瘤细胞的免疫反应,并帮助机体免疫系统生成针对其他肿瘤抗原的新 T 细胞。在小鼠试验中,研究人员发现这种方法可以明显增加细胞治疗清除实体肿瘤的可能性。相关研究已于近期发表在 Cell 上。
(来源:Cell)
本文的第一作者是 Leyuan Ma 博士,通讯作者是 Darrell Irvine 教授。Leyuan Ma 此前曾在 MIT 科赫研究所从事博士后研究,现在是宾夕法尼亚大学医学院病理学和检验医学助理教授。他的研究方向是免疫调节、免疫传感和免疫疗法;Darrell Irvine 是 MIT 科赫研究所副主任、生物工程与材料科学与工程教授以及霍华德休斯医学研究所研究员,通过结合免疫学、生物技术和材料化学设计免疫治疗,采用工程化方法构建创新型免疫疗法。包括用于开发针对传染病和癌症增强型疫苗的智能材料和纳米技术,基于纳米材料的免疫疗法以及调控和监测免疫系统的新工具。
“这种疫苗可能增强了称之为抗原扩散(Antigen Spreading)的过程,在这个过程中,机体的免疫系统与工程化修饰的 CAR-T 协同攻击肿瘤细胞。疫苗+CAR-T 的方法能够明显增强细胞疗法对肿瘤的杀伤效果,还可以生成针对其他肿瘤抗原的工程化 T 细胞疗法,进一步增强对肿瘤的杀伤作用。”Darrell Irvine 在新闻稿中解释道。
疫苗驱动抗原扩散,可增强 CAR-T 疗效,部分小鼠可根除实体瘤
以胶质母细胞瘤为例,并非所有胶质母细胞瘤细胞都会表达靶抗原。当癌细胞受到 CAR-T 攻击时,一些胶质母细胞瘤细胞会通过停止产生靶抗原来做出反应,从而逃过免疫系统的攻击。针对这种情况,研究人员设计出了一种疫苗+CAR-T 疗法组合的方式,以期能够在实体瘤中高效杀伤肿瘤细胞。
2019 年,研究人员设计出了一种两亲性 CAR-T 配体(amph-ligands)疫苗,注射后,它们会递送到淋巴结并修饰抗原呈递细胞表面,从而在天然淋巴结微环境中激活 CAR-T。这些配体会促进 CAR-T 活化、大规模扩增,并增加抗肿瘤杀伤作用。在小鼠试验中,接受疫苗+CAR-T 细胞治疗,能够放大治疗效果,其中 60% 小鼠体内的实体瘤可以完全清除。
当时研究人员表示,该系统有潜力用于增强各种 CAR-T 细胞的活性。
(来源:Science)
在最新的试验中,研究人员探索了在组合治疗过程中如何激活 T 细胞反应。在试验中,研究人员采用了 2019 年试验中相同类型的 CAR-T 细胞和相同的疫苗,其中 CAR-T 细胞是针对 EGFR 突变体设计的。试验期间,小鼠注射两剂疫苗,间隔一周。
研究人员发现,在这些增强小鼠中,CAR-T 细胞发生了代谢变化,增加了干扰素 γ 的产生,干扰素是一种有助于刺激强烈免疫反应的细胞因子。并可以帮助 T 细胞克服实体肿瘤的免疫抑制微环境。
在 CAR-T 细胞攻击表达靶抗原的肿瘤细胞时,宿主 T 细胞会遇到肿瘤细胞释放的其他肿瘤抗原,此时这些宿主 T 细胞会被提示靶向这些肿瘤抗原,协同攻击肿瘤细胞,增加肿瘤细胞的杀伤力。
与此同时,研究人员也发现,如果没有产生宿主 T 细胞的免疫反应,这种情况下,即使 CAR-T 细胞破坏了大部分原始的肿瘤细胞,后续肿瘤细胞还会复发,重新长出来。这主要是由于上文提到的当一些肿瘤细胞接受了CAR-T 细胞治疗时,肿瘤细胞会做出停止表达靶抗原的反应,从而这些暂停表达靶抗原的肿瘤细胞会逃过免疫细胞的攻击。
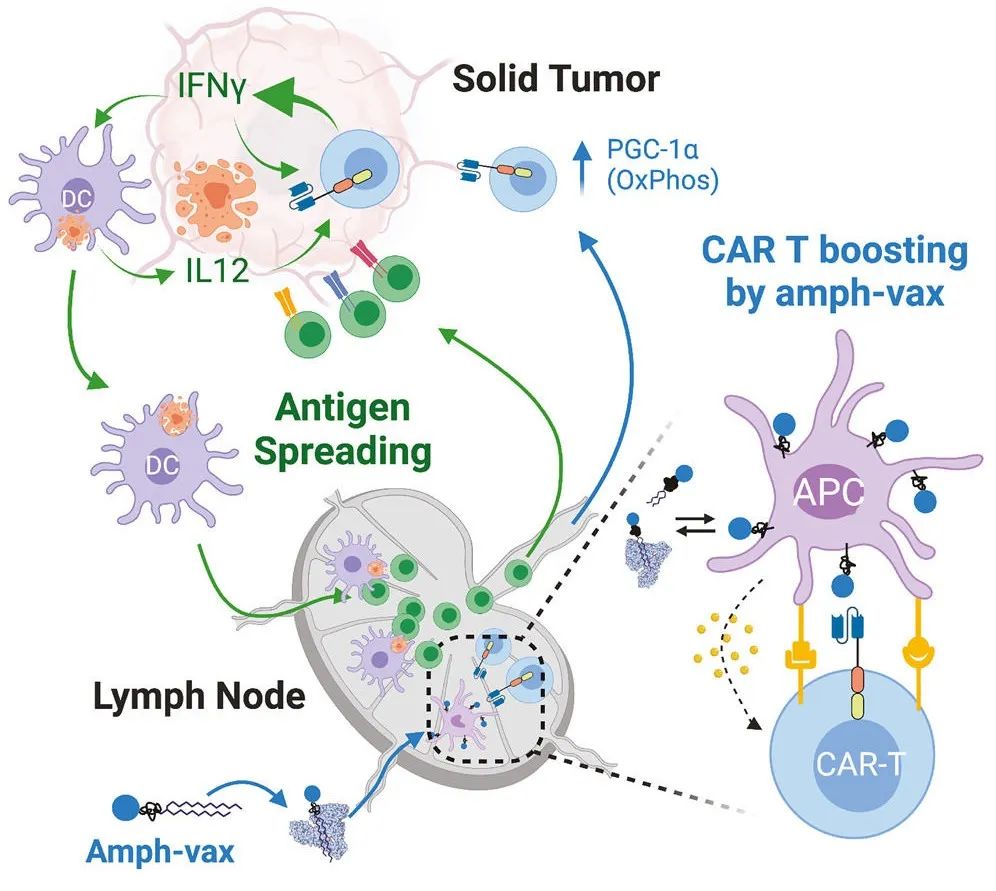
(来源:Cell)
“这种疫苗可以驱动抗原扩散(AS)反应,不仅有助于工程化 CAR-T 细胞攻击肿瘤,而且我们还发现了一个意外惊喜,即该疫苗可生成针对其他肿瘤抗原的T 淋巴细胞群。这些 T 细胞群会与 CAR-T 细胞协同工作,完全清除肿瘤并防止肿瘤再生。同时,研究也证实了抗原扩散对于避免抗原丢失介导的肿瘤逃逸和控制抗原异质性肿瘤至关重要。”
这进一步证明了抗原扩散在细胞治疗过程中的可行性。不同于针对原治疗靶标,抗原扩散是一种诱导和放大第二抗原免疫反应的过程。通常认为,一种可靶向肿瘤抗原且同时诱导针对其他肿瘤抗原的内源性 T 细胞反应的 CAR-T 细胞是一种极具潜力的方法。
然后,研究人员使用不同靶抗原表达比例的肿瘤小鼠评估肿瘤根除情况。他们发现,整体来看,CAR-T 和宿主 T 细胞组合可以清除大约 25% 的肿瘤,50% 抗原表达比例的情况亦然;在靶抗原表达比例较高的肿瘤小鼠体内的清除率相对更高,80% 肿瘤细胞表达 CAR-T 细胞靶抗原时,大约 80% 的小鼠体内肿瘤被完全清除。
可用于不同 CAR-T 细胞,相关管线已进入临床 I 期
公开资料显示,几乎很少有实体瘤肿瘤细胞表达靶抗原的比例能超过 90%,这也表明研究中的这种系统可以为设计更高效的 CAR-T 细胞疗法提供一定的指导。
新闻稿中也提到,这种疫苗已经在临床上进行了探索,且研究证明这种方法可以转化为 CAR -T 细胞临床试验。
事实上,Darrell Irvine 已经参与创办了 Elicio Therapeutics(NASDAQ: ELTX) ,推进这类工程化方法的落地。Darrell Irvine 是该公司的联合创始人、顾问、董事会观察员以及科学顾问委员会主席。
这是一家处于临床阶段的生物制药公司,成立于 2011 年,上个月完成了反向并购,成为一家纳斯达克证券交易所上市公司。该公司专注于设计人体的免疫反应,通过开发淋巴结靶向免疫疗法和疫苗治疗癌症和传染病。
官方新闻稿中提到,Elicio Therapeutics 拥有本研究中所用底层技术的专利许可。Darrell Irvine 指出,理论上,这种方法应该适用于与任何确定肿瘤抗原的 CAR-T 协同攻击实体瘤。我们还在研究调整这种增强 CAR-T 细胞疗法的方法,以便将其用于攻击尚未确定靶向抗原的肿瘤。
根据官网的介绍,该公司已经搭建了专有的 Amphiphile (AMP)平台,这一技术平台结合了材料科学和免疫学方面的专业知识,可以通过智能递送到淋巴结,作出较强的免疫反应。该平台旨在基于较大分子向淋巴系统递送相关的治疗性有效负载。其也可以重新编程生物分布,促进有效负载(例如抗原、佐剂)向淋巴结的靶向递送。
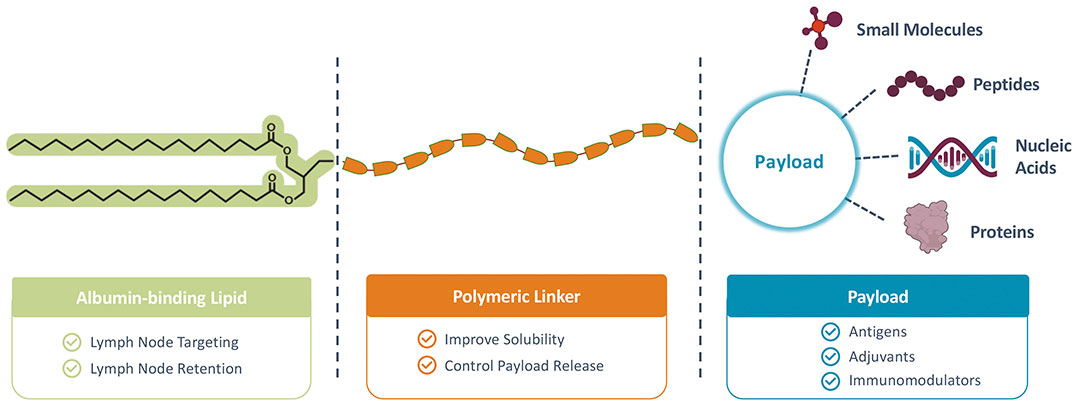
▲图 |AMP 技术平台(来源:公司官网)
该平台的重点是靶向经过生物学验证但难以药物治疗靶点,针对这些靶点开发新型免疫疗法和疫苗,包括针对一系列侵袭性癌症和传染病的细胞疗法激活剂、免疫调节剂、佐剂和疫苗。
其中核心业务是开发癌症疫苗,尤其是 ELI-002 ,这也是该公司进展最快的在研管线。ELI-002 旨在刺激针对导致 25% 实体瘤的七种 Kirsten 大鼠肉瘤病毒癌基因(KRAS)突变体的免疫反应。目前,该管线正在进行一项临床 I 期剂量递增研究 AMPLIFY-201 和一项 I/II 期研究 AMPLIFY-7P。
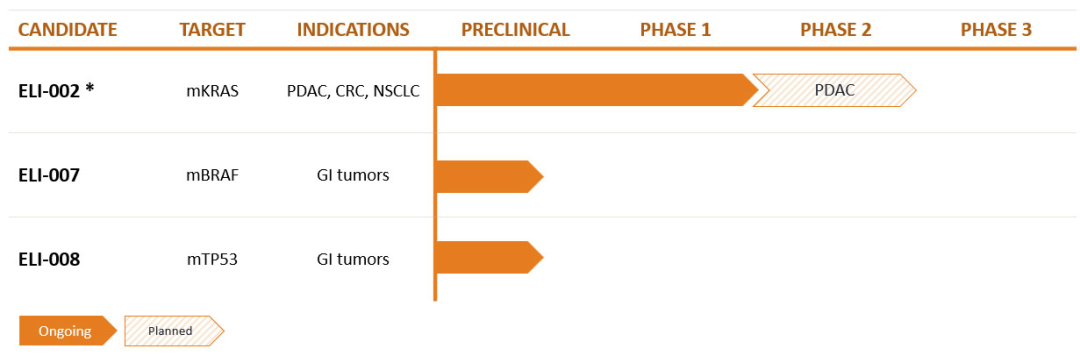
▲图 | 在研管线(来源:公司官网)
该公司已经在 2023 ASCO 年会上公布论文 ELI-002 临床 I 期剂量递增研究的第一份数据。试验数据显示,ELI-002 耐受性良好,在 5 个队列中没有出现剂量限制性毒性或细胞因子释放综合征。在所有剂量水平下均观察到反应,其中大部分患者(77%)的肿瘤生物标志物减少,一部分患者(32%)实现完全清除。87% 的患者诱导了 mKRAS 特异性 T 细胞反应,100% 的患者在最终剂量水平下有反应。预计 AMPLIFY-201 的更多后续数据将于 2023 年下半年得出。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




