《自然》:衰老肺组织“唤醒”休眠癌细胞!
来源:奇点糕 2022-06-22 10:24
肿瘤转移是引起肿瘤相关死亡的重要原因,然而目前我们对肿瘤转移以及转移瘤形成的机制还不是非常清楚。
肿瘤转移是引起肿瘤相关死亡的重要原因,然而目前我们对肿瘤转移以及转移瘤形成的机制还不是非常清楚。
肿瘤的转移是一个多步骤的过程,早在原发瘤刚形成时便有肿瘤细胞脱离原位向外播散[1],但是转移瘤的形成往往滞后很多,这可能是由于肿瘤细胞会在转移部位进入休眠。肿瘤细胞的休眠可以防止其被免疫系统清除,有助于其在转移部位的散播以及定植[1],而一旦其从休眠中“觉醒”,则会导致转移瘤的形成。
近日,由约翰·霍普金斯大学布隆伯格公共卫生学院Ashani T. Weeraratna教授领衔的研究团队在著名期刊Nature上发表研究成果[2],他们发现衰老的肺部微环境可以诱导休眠的黑色素瘤细胞转变为增殖活跃状态,从而形成肺部转移瘤。机制上,WNT5A是促进转移黑色素瘤细胞进入休眠的关键分子;而衰老的肺部成纤维细胞可以分泌WNT5A拮抗剂sFRP1,从而打破了黑色素瘤细胞的休眠使其进入活跃的增殖期,促进转移瘤的形成。
这项研究成果清晰地揭示了在衰老肺部中黑色素瘤细胞结束休眠的机制,加深了我们对肿瘤转移以及转移瘤形成的理解,并且为我们后续开发抗肿瘤转移疗法提供了参考。

论文首页截图
黑色素瘤是一种恶性皮肤癌,有着较强的转移能力。有研究发现,相比于年轻小鼠,植入老年小鼠皮肤的黑色素瘤虽然生长更加缓慢,但是却更容易发生肺转移[3]。目前尚不清楚这是由于来自原发瘤的转移性肿瘤细胞数增加,还是因为衰老个体肺部微环境变化促进了转移瘤形成。
为了探究这个问题,Weeraratna教授研究团队为年轻小鼠(8周龄)以及老年小鼠(52周龄以上)皮内接种了mCherry+黑色素瘤细胞,并使用免疫组织化学染色(IHC)检测接种后不同时间点小鼠肺部mCherry+肿瘤细胞的数量。
实验结果显示,虽然在接种后第3周,两组小鼠肺部定植的mCherry+肿瘤细胞数没有明显区别,但是接种后第5周老年小鼠肺部形成了明显的肿瘤灶,而年轻小鼠却没有。IHC检测发现年轻小鼠肺部定植的肿瘤细胞增殖标志物Ki67大多为阴性,而老年小鼠肺部肿瘤细胞基本为Ki67阳性。这些数据提示衰老的肺部有利于肿瘤的增殖与转移瘤形成。
为了进一步验证衰老的肺部微环境才是导致肿瘤生长更加迅速的原因,研究团队构建了尾静脉转移模型,发现在注射了同样数量的肿瘤细胞后老年小鼠肺部出现更多的肿瘤结节,这表明衰老的肺部微环境是导致肿瘤转移负荷增加的原因。
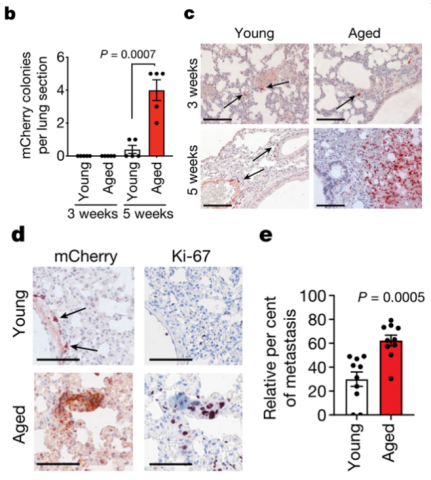
在皮内以及尾静脉接种肿瘤细胞后,老年小鼠肺部出现更多的转移灶
那么引起肿瘤细胞在衰老个体肺部生长更加迅速的原因是什么呢?
此前有报道称,皮肤中成纤维细胞是导致年轻小鼠与老年小鼠黑色素瘤生长以及转移差异的关键角色[3];因此,研究团队将黑色素瘤细胞与来自年轻(35岁或以下)或老年(55岁或以上)健康捐赠者的人皮肤或肺成纤维细胞共同培养,进行3D胶原重建,观察肿瘤细胞的生长速度。
结果与小鼠活体实验一致,黑色素瘤细胞在老年肺成纤维细胞微环境中的增殖速度比在年轻肺成纤维细胞环境中的黑色素瘤细胞更快,而在老化的皮肤成纤维细胞微环境中的黑色素瘤细胞比在含有年轻皮肤成纤维细胞的微环境中的黑色素瘤细胞增殖更慢。使用来自成纤维细胞的条件培养基进行2D细胞培养也得到了相同的结论,这说明衰老个体的肺成纤维细胞分泌的可溶性物质在促进黑色素瘤生长的过程中发挥了重要作用。
为了进一步寻找成纤维细胞用来促进肿瘤生长的物质,研究团队对健康的年轻人和老年人的肺成纤维细胞的分泌物进行了蛋白质组学分析,发现老年人肺成纤维细胞分泌更多的sFRP1——一种非经典的WNT通路抑制分子。
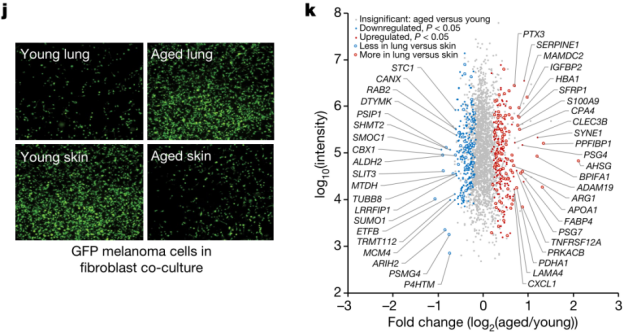
衰老个体肺部成纤维细胞能够促进肿瘤细胞增殖,并且这可能是通过可溶型分泌物介导的
因为WNT5A被证明可以促进多种肿瘤细胞的休眠[4],所以研究团队猜想,sFRP1可能是通过抑制WNT5A信号,从而使肿瘤细胞从休眠中醒来,恢复增殖。
为了证明这个猜想,他们使用来源肺成纤维细胞的条件培养基培养黑色素瘤细胞,发现来自老年肺成纤维细胞的培养基能够显著抑制黑色素瘤细胞中非经典的WNT5A信号,并降低休眠相关基因表达,而增加增殖相关基因的表达。更进一步的,研究团队使用重组FRP1处理黑色素瘤细胞,发现其也能够起到抑制WNT5A信号、降低休眠标志基因表达而增加增殖标志物的表达;当敲低老年肺成纤维细胞中的sFRP1后再将其与黑色素瘤细胞共培养则发现肿瘤细胞的生长变缓。这些数据表明,老年肺成纤维细胞可能是通过分泌sFRP1来唤醒休眠的肿瘤细胞。
为了在体内实验中验证上述发现,研究团队在给老年小鼠皮内接种mCherry+黑色素瘤细胞3周后(此时小鼠肺部已经有单个肿瘤细胞定植)为小鼠注射sFRP1中和抗体,观察小鼠肺部肿瘤生长情况发现,中和sFRP1后小鼠肺部肿瘤结节数明显减少,并且增殖标志物Ki67的水平显著低于IgG对照组。这些数据表明衰老肺部中的成纤维细胞可以通过分泌sFRP1结束肿瘤细胞的休眠,从而促进转移瘤形成。
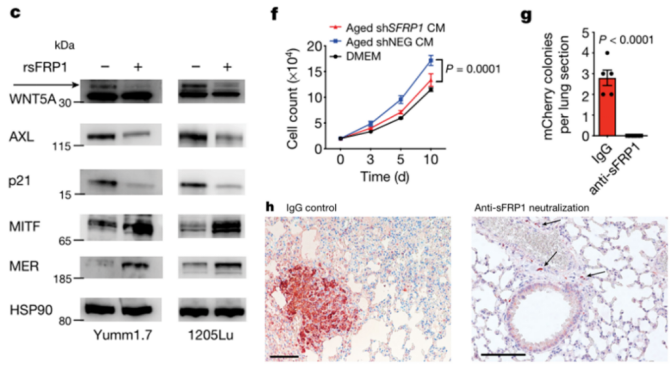
sFRP1能够唤醒休眠的肿瘤细胞,促进转移灶形成
鉴于上述结果提示WNT5A在肿瘤细胞休眠中有重要作用,研究团队选择将其作为肺转移性黑色素瘤休眠的主要因素进行研究。通过TCGA数据库分析,他们发现WNT5A的表达与多种休眠标志物呈正相关,而与增殖标志物呈现负相关;并且在多个黑色素瘤数据集中均发现WNT5A的高表达与肿瘤的侵袭性呈现正相关。因此,研究团队猜想:WNT5A的表达有助于肿瘤的远端侵袭,但是形成转移瘤需要下调WNT5A的表达以增强肿瘤细胞的增殖能力。
为了在体内实验中验证上述猜想,研究团队构建了他莫昔芬(DOX)诱导的细胞系,可以在DOX处理下诱导表达针对WNT5A的shRNA从而降低WNT5A的表达量。在为小鼠皮内接种该肿瘤细胞后第3天或第21天开始给予小鼠DOX处理以降低WNT5A的表达,发现不论在哪个时间点进行DOX处理均能加快原发瘤的生长;而在第3天开始DOX处理使肺脏中定植的肿瘤细胞数显著减少;在第21天开始DOX处理则使肺脏出现更多的肿瘤结节。这些数据表明WNT5A能够促进肿瘤细胞的侵袭与定植,但是减弱了肿瘤细胞的增殖能力。
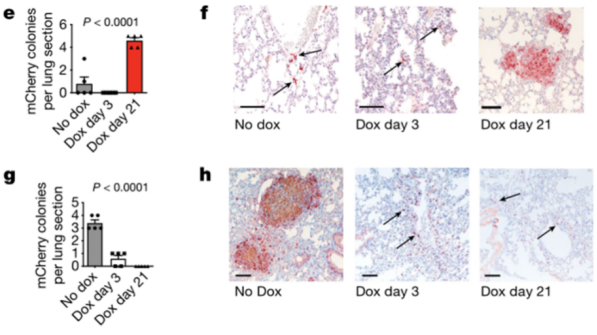
e,f:在年轻荷瘤小鼠中诱导肿瘤细胞敲低WNT5A促进肺部定植的肿瘤细胞增殖,形成转移灶;g,h:在老年荷瘤小鼠中诱导肿瘤细胞过表达WNT5A抑制转移灶形成
上述结果证明了WNT5A在调控肿瘤细胞侵袭与增殖中的关键作用,研究团队想知道WNT5A是如何被调控的,他们将目光放在了TAM家族酪氨酸激酶受体家族上。根据已有的研究报道[5-9],他们推测在黑色素瘤细胞中AXL与MER的差异表达可能构成了转移组织中肿瘤细胞的休眠-再激活轴。
为了在体内探究MER以及AXL在肿瘤转移以及休眠-再激活中的作用,研究团队构建了DOX诱导过表达MER的黑色素瘤细胞系。在给年轻小鼠皮内接种肿瘤细胞后第3天或第21天开始给予小鼠DOX处理,发现只有在第21天开始DOX处理才能够增加肺脏中转移灶的数量,而在第3天开始DOX处理显著减少了肺脏中定植的单个肿瘤细胞数量。这些数据表明,原发瘤的扩散需要低表达MER(与WNT5A相反);而在肺内定植后,上调MER表达则有利于形成更大的转移灶。同理,借助DOX诱导过表达AXL的黑色素瘤细胞系,研究团队并在老年荷瘤小鼠中证明,AXL可以诱导肿瘤细胞休眠,抑制定植的肿瘤细胞增殖形成明显的转移灶。
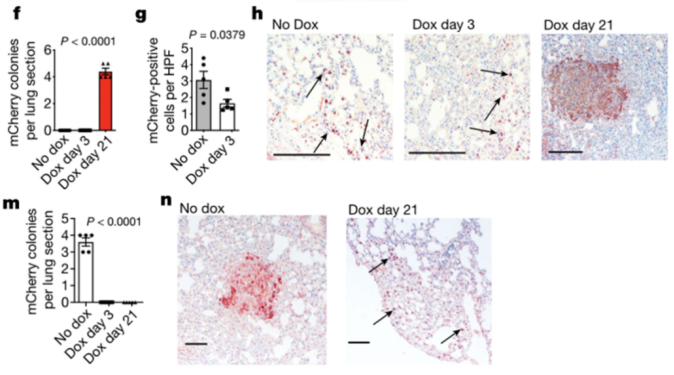
f-h:上调MER有助于肺部定植肿瘤细胞增殖形成转移瘤,但抑制原发瘤的转移能力;m,n:上调AXL诱导肺部定植肿瘤细胞休眠,抑制转移瘤形成
总的来说,这项研究成果清晰地揭示了衰老个体肺部微环境变化对肺转移瘤形成的影响,这有助于理解肿瘤的远端转移与复发机制,并且有助于在未来开发针对休眠肿瘤细胞的治疗策略。同时这篇论文也让人好奇WNT5AHigh休眠肿瘤细胞与肿瘤干细胞之间有怎样的关系,它们是否是同一群细胞?肿瘤干细胞是否需要WNT5A信号维持静息状态?
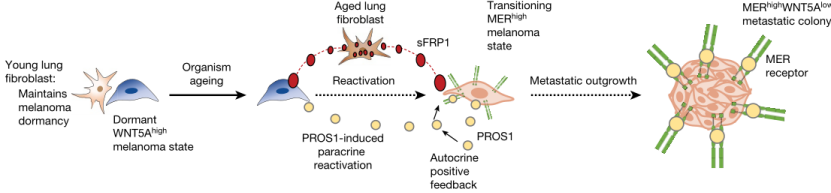
本研究机制总结图
参考文献:
1. Jehanno C, Vulin M, Richina V, Richina F, Bentires-Alj M. Phenotypic plasticity during metastatic colonization [published online ahead of print, 2022 Apr 25]. Trends Cell Biol. 2022;S0962-8924(22)00079-4. doi:10.1016/j.tcb.2022.03.007
2. Fane, M.E., Chhabra, Y., Alicea, G.M. et al. Stromal changes in the aged lung induce an emergence from melanoma dormancy. Nature (2022). https://doi.org/10.1038/s41586-022-04774-2
3.Kaur A, Webster MR, Marchbank K, et al. sFRP2 in the aged microenvironment drives melanoma metastasis and therapy resistance. Nature. 2016;532(7598):250-254. doi:10.1038/nature17392
4. Lambert AW, Pattabiraman DR, Weinberg RA. Emerging Biological Principles of Metastasis. Cell. 2017;168(4):670-691. doi:10.1016/j.cell.2016.11.037
5. Wellbrock C, Arozarena I. Microphthalmia-associated transcription factor in melanoma development and MAP-kinase pathway targeted therapy. Pigment Cell Melanoma Res. 2015;28(4):390-406. doi:10.1111/pcmr.12370
6. Schoumacher M, Burbridge M. Key Roles of AXL and MER Receptor Tyrosine Kinases in Resistance to Multiple Anticancer Therapies. Curr Oncol Rep. 2017;19(3):19. doi:10.1007/s11912-017-0579-4
7. Yumoto K, Eber MR, Wang J, et al. Axl is required for TGF-β2-induced dormancy of prostate cancer cells in the bone marrow. Sci Rep. 2016;6:36520. Published 2016 Nov 7. doi:10.1038/srep36520
8. Tworkoski KA, Platt JT, Bacchiocchi A, Bosenberg M, Boggon TJ, Stern DF. MERTK controls melanoma cell migration and survival and differentially regulates cell behavior relative to AXL. Pigment Cell Melanoma Res. 2013;26(4):527-541. doi:10.1111/pcmr.12110
9. Zhu S, Wurdak H, Wang Y, et al. A genomic screen identifies TYRO3 as a MITF regulator in melanoma. Proc Natl Acad Sci U S A. 2009;106(40):17025-17030. doi:10.1073/pnas.0909292106
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


