胡海岚团队最新Cell论文:揭开压力传播路径——神经元和胶质细胞上演的“动态探戈”诱导抑郁症
来源:生物世界 2025-04-26 08:54
这项研究解开了 NE 在抑郁症中的“矛盾密码”,揭示了压力导致抑郁的核心机制,为临床治疗提供了多个可成药的抗抑郁分子靶点。
浙江大学脑科学与脑医学学院/双脑中心胡海岚教授团队在国际顶尖学术期刊 Cell 上发表题为:Neuron-astrocyte Coupling in Lateral Habenula Mediates Depressive-like Behaviors 的研究论文。
该研究聚焦大脑内两类主要的细胞类群:神经元和星形胶质细胞,系统解析了压力导致抑郁的神经胶质动态交互机制。研究团队绘制了大脑内压力信号传输的时序图谱,首次发现由外侧缰核(LHb)神经元、蓝斑核去甲肾上腺素能(LC-NE)神经元及外侧缰核(LHb)星形胶质细胞构成的循环神经网络,在应激压力和抑郁发生中的关键作用。这三组特异性的细胞类群形成循环的“铁三角”动态编码压力的发生,该循环神经网络反复激活会诱发抑郁症。
通过实时追踪压力信息在大脑中的传输时序,研究团队还揭示了去甲肾上腺素(NE)在抑郁症中看似矛盾的角色背后的核心机制:NE 调控的关键不在于“总量多少”,而在于“释放节奏”。这些研究成果为深入理解抗抑郁药物的作用机制提供了全新视角,对阐明压力相关精神障碍的病理机制具有重要的科学价值。阐释应激压力导致抑郁的动态编码规律、核心神经环路和关键信号分子,为压力管理和抑郁预防提供了新的诊疗策略。

外侧缰核暗藏压力密码
缰核(Habenula)是位于大脑皮层下的一个核团,因其解剖形态与缰绳相似而得名。这个古老的核团在进化上高度保守,广泛存在于所有的脊椎动物中。其中,外侧缰核在情绪调控中具有重要作用。外侧缰核神经元会被失望、恐惧等一系列负面情绪显著激活,进而抑制与奖赏相关的多巴胺能神经元。因此,外侧缰核被称为“大脑的反奖赏中心”。既往研究普遍聚焦于外侧缰核的神经元,而占脑内半数的星形胶质细胞在应激压力和抑郁症中的功能长期处于研究盲区。
为研究这个“盲区”,研究团队向小鼠施加足底电击引发其产生压力效应,利用多通道光纤记录技术,实时监测了多个脑区星形胶质细胞的钙信号。团队发现,压力会激活大脑中多个脑区的星形胶质细胞,传统认知中作为大脑“胶水”的星形胶质细胞可以像神经元一样被兴奋。其中,外侧缰核的星形胶质细胞反应速度最快、活跃度最高,堪称压力响应的“先锋部队”。
另一方面,在对神经元钙活动记录中,研究团队进一步观察到:当小鼠遭遇压力时,外侧缰核神经元会先爆发一波快速而猛烈的钙活动,短暂回落后紧接着又产生第二波持续时间更长的钙活动。与其他脑区单次响应不同,外侧缰核神经元呈现独特的“双脉冲激活模式”(Biphasic Ca2+ activity),仿佛对同一刺激做出“双重确认”(Double-take)。这些结果提示外侧缰核这一核团在大脑压力信息处理中可能发挥关键作用。
因此,研究团队接下来同步监测了外侧缰核神经元和星形胶质细胞的活动。记录结果显示:外侧缰核的神经元和星形胶质细胞在应激压力下上演精准接力,星形胶质细胞的活动精准卡位在神经元两次活动之间。根据这一现象,研究团队猜测,是否外侧缰核神经元触发星形胶质细胞响应,星形胶质细胞反过来推动神经元的第二波活动。
三类细胞循环接力传递压力信息
为了验证上述假设,研究团队开展了一系列在体和离体实验。结果出人意料:在自由活动的小鼠中,外侧缰核神经元可以迅速启动星形胶质细胞响应,然而在离体脑片中,这一“遥控效应”却完全消失。这一现象提示,外侧缰核神经元并非通过局部信号直接驱动星形胶质细胞,而是依赖于在体环境特有的"中介信使"。结合药理学和光遗传学实验,研究团队最终锁定了这一“信号中转站”——蓝斑核。
蓝斑核位于脑干,是大脑中“压力分子”去甲肾上腺素的主要生产中心。团队发现,外侧缰核神经元通过调动下游蓝斑核去甲肾上素能神经元 “跨区遥控”星形胶质细胞。进一步的实验揭示,外侧缰核星形胶质细胞释放 ATP/腺苷和谷氨酸两种胶质递质,以“组合拳”的方式推动神经元的第二波活动。综合这些发现,研究团队勾勒出压力信息在大脑中的传播路径:当压力来袭,外侧缰核神经元率先发出“警报”,激活蓝斑核去甲肾上腺素能神经元释放去甲肾上腺素,这些“压力分子”到达外侧缰核后,启动星形胶质细胞的活动,外侧缰核星形胶质细胞承前启后,通过释放双重递质为神经元的第二波活动 “蓄能加压”。
压力循环与抑郁
基于上述解析的“外侧缰核神经元-蓝斑核去甲肾上腺素能神经元-外侧缰核星形胶质细胞”循环神经网络,研究团队评估了该网络的抑郁调控功能。实验结果发现,特异性激活外侧缰核星形胶质细胞,会显著降低小鼠的抗压能力,少数几次的压力刺激,便足以诱发情绪“崩盘”。相反,当研究团队使用抑制星形胶质细胞钙活动的工具“封印”外侧缰核星形胶质细胞时,即使在高压情况下,小鼠依然能维持情绪稳定,未出现抑郁状态。这些结果证实了循环“铁三角”在压力诱发抑郁症中的核心作用。
去甲肾上腺素的“矛盾密码”
临床上常用的抗抑郁药物,包括:三环类抑制剂(TCA)、选择性血清素-去甲肾上腺素再摄取抑制剂(SNRI)以及去甲肾上腺素再摄取抑制剂(NRI),这些药物会抑制去甲肾上腺素转运体(NET),阻断去甲肾上腺素(NE)的再摄取过程,增加胞外 NE 的浓度。团队在研究过程中发现,压力也会引起胞外 NE 浓度升高,这些 NE 分子会激活外侧缰核的星形胶质细胞,驱动“外侧缰核神经元-蓝斑核去甲肾上腺素能神经元-外侧缰核星形胶质细胞”循环网络,引发抑郁症。这直接触及了精神疾病领域长期存在的核心争议:NE 分子究竟是抑郁症的“解药”还是“毒药”?
这个谜团,在这项研究中得以解开。原来,NE 的功能远非简单的“多与少”——其“释放模式”才是关键。通过实时监测 NE 的动态,研究团队捕捉到,在应激压力下,外侧缰核存在两种去甲肾上腺素释放模式:一种是瞬时的强烈释放(Phasic);另一种是缓慢的持续释放(Tonic)。值得注意的是,只有瞬时释放(Phasic)模式才能有效启动外侧缰核星形胶质细胞的钙活动。而抗抑郁药 SNRI、NRI 缓慢增加胞外 NE 的浓度,这种模式虽然提高了胞外 NE 浓度,但并不能激活外侧缰核的星形胶质细胞。相反,由于这类药物持续阻断 NE 的回收,导致神经元内部 NE 库存不足,反而抑制了 NE 瞬时释放(Phasic),使得星形胶质细胞无法完成压力信号的传导,从而阻断压力信号的循环。因此团队预测,这类药物很可能预防抑郁症的发生,并且在实验中验证了这一推测 ——在压力来临前提前给予 NRI,预防了抑郁行为的出现。
这项研究解开了 NE 在抑郁症中的“矛盾密码”,揭示了压力导致抑郁的核心机制,为临床治疗提供了多个可成药的抗抑郁分子靶点。
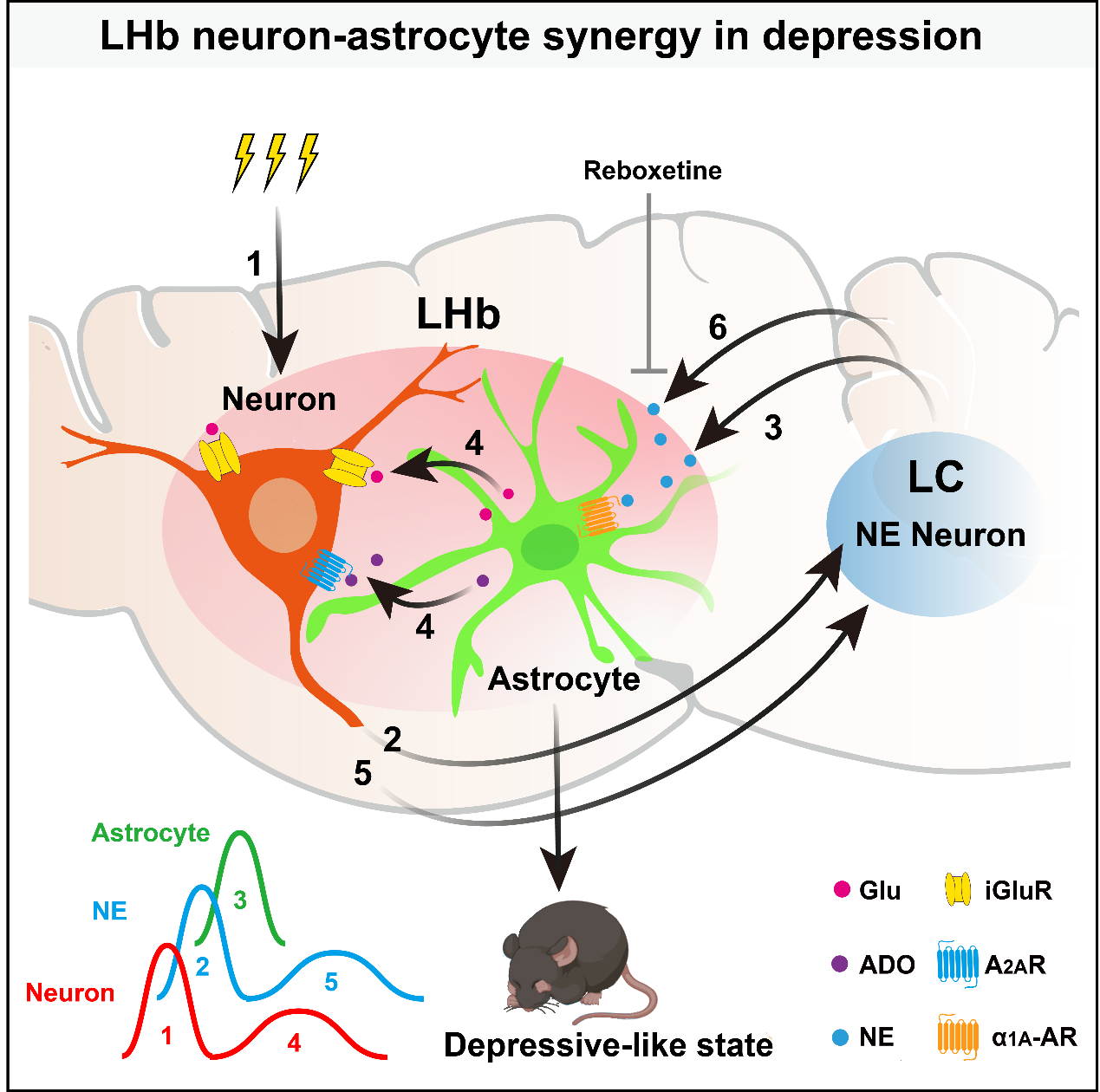
图外侧缰核和蓝斑核循环接力传递压力信息,介导抑郁症的发生
浙江大学医学院脑科学与脑医学学院/教育部脑与脑机融合前沿科学中心/脑机智能全国重点实验室/南湖实验室/新基石研究员胡海岚教授为论文通讯作者,博士生辛倩倩、王俊盈为论文共同第一作者。此外,马欢教授、李晓明教授、本科生郑锦坤、博士后檀毅、博士生贾晓宁、博士后倪哲一、本科生徐子杰、北京大学李毓龙教授、冯杰思博士和武照伐博士(现为中国科学院遗传与发育生物学研究所研究员)也在其中做出了重要贡献。该研究主要受科技创新2030重大项目、国家自然科学基金、上海高等研究院繁星科学基金、科技创新2030“脑科学与类脑研究”重大项目、国家自然科学基金重点项目/基础科学中心项目、新基石研究员项目、浙江省“尖兵领雁”科技计划项目、中央基本科研业务费、中国医学科学院中央级公益性科研院所基本科研业务费、杭州市第七人民医院高峰学科项目和杭州市医学重点学科建设项目的资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


