Mol Cancer | 四川大学周红梅/罗晶晶揭示DNMT1增强口腔鳞状细胞癌的肿瘤抑制和规避毒性的机理
来源:生物探索 2024-05-23 09:21
该研究表明,DNMT1可以作为多种信号的重要看门人,使其成为控制口腔肿瘤转化和改善OSCC治疗的有希望的靶点。
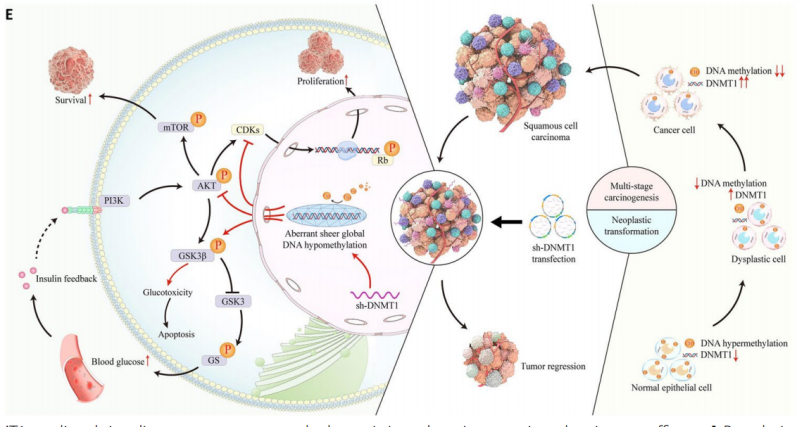
四川大学周红梅及罗晶晶共同通讯在Molecular Cancer在线发表题为“DNMT1-targeting remodeling global DNA hypomethylation for enhanced tumor suppression and circumvented toxicity in oral squamous cell carcinoma”的研究论文,该研究表明DNMT1靶向重塑整体DNA低甲基化增强口腔鳞状细胞癌的肿瘤抑制和规避毒性。该研究发现在人类口腔恶性转化过程中DNMT1的表达稳步提高,并且在体外和异种移植的OSCC模型中,DNMT1的抑制大大降低了致瘤性。在口腔癌发生过程中,DNMT1过表达伴随着癌症特异性DNA低甲基化的积累;相反,在癌细胞和异种移植肿瘤中,DNMT1敲低导致非典型的广泛的全基因组DNA低甲基化。
这种新的DNMT1重塑的DNA低甲基化模式阻碍了PI3K-AKT和CDK2-Rb的双重激活,并协同失活GSK3β。在治疗OSCC小鼠时,靶向DNMT1获得了比PI3K抑制剂更大的抗癌效果,并且降低了PI3K抑制剂或PI3K与CDK抑制剂联合引起的血糖变化以及胰岛素不良反馈的毒性。靶向DNMT1重塑了一种新的全球DNA低甲基化模式,以促进抗癌功效,并通过平衡的信号协同作用将潜在的毒性作用降至最低,DNMT1是OSCC命运和治疗结果的关键“看门人”。

口腔鳞状细胞癌(Oral squamous cell carcinoma, OSCC)是一种起源于口腔上皮细胞的异质性恶性肿瘤。由于OSCC患者在治疗后容易复发和转移,尤其是晚期患者的生存率较低。为了改善OSCC患者的生存结果,新的治疗方法被设计出来,通过选择性地靶向癌细胞中的异常信号分子或蛋白质,如EGFR和PD-L1,来延长OSCC患者的生存时间。然而,这些靶向治疗的疗效经常受到癌细胞中药物耐药性的阻碍,这可归因于多种因素,包括基因组不稳定、信号级联失调或药理学毒性。
DNA甲基化是一种普遍的表观遗传修饰,在真核生物中控制着基因表达模式、细胞类型特异性基因组稳定性和胚胎发育,与口腔癌的进展密切相关。随着细胞增殖,与癌变相关的DNA甲基化模式的改变逐渐进展。值得注意的是,癌细胞具有全基因组DNA低甲基化景观,导致癌细胞不稳定和肿瘤异质性。
DNA甲基转移酶1 (DNMT1)是最常见的DNA甲基转移酶,在DNA复制过程中对维持DNA甲基化稳态至关重要。早期的研究预测DNMT1是与OSCC进展相关的潜在靶点。既往研究表明,抑制DNMT1对多种类型的鳞癌均有正向的抗癌作用。然而,DNMT1通过DNA甲基化和信号转导调节OSCC的发生和进展的机制在很大程度上仍然未知。
DNMT1依赖的全局DNA甲基化模式在口腔癌的发生和治疗中起作用(Credit: Molecular Cancer)
该研究整合了来自临床人类样本、异种移植小鼠模型的多层实验数据,以及独立的高通量DNA甲基化微阵列分析以及大量和单细胞转录组分析。研究证明,DNMT1敲低可在OSCC细胞中重塑全基因组DNA低甲基化。这种新的DNMT1特异性DNA低甲基化模式触发PI3K-AKT和CDK2-Rb的双重抑制以及GSK3β的失活,与PI3K抑制剂相比,导致肿瘤消退增强。GSK3β失活还可以抵消PI3K抑制引起的高血糖和胰岛素反馈的不良药理毒性。这些联合作用产生了信号转导的协同作用,最终提高了治疗OSCC的疗效,降低了毒性。该研究表明,DNMT1可以作为多种信号的重要看门人,使其成为控制口腔肿瘤转化和改善OSCC治疗的有希望的靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


