Nature Aging:炎症诱导表观遗传侵蚀,促进衰老干细胞铁死亡
来源:生物世界 2025-07-03 09:21
这些发现揭示了一种表观遗传开关,它将慢性炎症与肌肉干细胞衰老和铁死亡联系起来,为对抗年龄相关肌肉退化提供了潜在治疗策略。
衰老的特征之一是整个生物体中干细胞的衰老、功能下降以及数量下降。全身性慢性低度炎症(炎性衰老)涉及循环促炎细胞因子和趋化因子水平升高,并导致干细胞衰老。异时性联体共生(Heterochronic Parabiosis,通过外科手术将两只不同年龄的动物的循环系统连接起来,使其共享血液和体液)研究表明,来自老年个体循环中的系统性因素可诱导过早衰老,而年轻个体的循环则能使老年组织恢复活力。然而,全身性炎症对肌肉干细胞(MuSC)衰老的具体影响,目前仍不清楚。
威斯康星大学麦迪逊分校、罗切斯特大学医学中心的研究人员在 Nature 子刊 Nature Aging 上发表了题为:Epigenetic erosion of H4K20me1 induced by inflammation drives aged stem cell ferroptosis 的研究论文。
该研究表明,全身性炎症通过诱导表观遗传侵蚀,促进肌肉干细胞发生铁死亡,而长期抑制全身性炎症,能够有效预防铁死亡,保持肌肉干细胞数量,并促进肌肉再生和功能恢复。

衰老是一个复杂的生物学过程,其特征是细胞和组织功能的逐渐衰退。在骨骼肌中,衰老表现为肌肉质量、力量和再生能力下降,导致老年人行动不便和生活质量下降。肌肉干细胞(MuSC),在肌肉修复和维持方面发挥着关键作用。然而,随着年龄的增长,肌肉干细胞的功能显著下降,导致老年肌肉的再生潜力降低。这种干细胞功能的衰退既归因于肌肉干细胞内部的变化,也归因于外部因素。
在内在因素中,表观遗传修饰在调控基因表达以及维持干细胞静止和激活状态方面发挥着重要作用。其中一种修饰是 H4K20 甲基化,这是一种关键的组蛋白标记,可调控染色质的致密化和基因组的稳定性。组蛋白 H4K20 甲基化的失调与包括肌肉干细胞在内的成体干细胞随年龄增长而衰退有关。精确的表观遗传重塑使肌肉干细胞在受损伤时能够脱离静止状态,并在再生过程中管理炎症信号。而表观遗传侵蚀(Epigenetic erosion),尤其是组蛋白修饰的失调,是衰老的核心所在,但其与慢性炎症之间的直接关系仍研究不足。
干细胞微环境中炎症水平升高,是导致干细胞衰老的最重要的外在因素之一。在骨骼肌中,已有大量研究表明,年龄相关的炎症会抑制其再生。在之前的研究中,该团队已经证明了在老年骨骼肌中促炎性 CCR2 信号通路的激活会阻碍年轻肌肉干细胞在移植到老年宿主后定植和再生的能力,突显了炎症环境的显著抑制作用。
此外,近期的研究成果强调了衰老细胞是肌肉干细胞微环境中年龄相关炎症的主要诱因,其在该环境中的积聚会损害肌肉干细胞对急性损伤的再生能力。而另一方面,全身性(而非局部)炎症对肌肉干细胞衰老的贡献尚未完全明了。
在这项最新研究中,研究团队探讨了慢性全身性炎症如何影响肌肉干细胞的命运和衰老。
研究团队揭示了一种机制——全身性炎症通过表观遗传侵蚀(Epigenetic erosion)促使肌肉干细胞(MuSC)衰老。研究团队证明,年龄相关炎症会降低 MuSC 中 H4K20 单甲基化水平,破坏其静止状态并诱导其发生铁死亡。
具体来说,炎症信号会下调负责 H4K20me1 积累的酶 Kmt5a,从而导致对抗铁死亡的基因发生表观遗传沉默,从而导致老年肌肉干细胞中铁代谢异常、活性氧水平升高以及脂质过氧化,进而发生铁死亡。值得注意的是,在小鼠 12 个月大时(中老年期)开始长期抑制全身性炎症,能有效预防铁死亡,保持肌肉干细胞数量,并促进肌肉再生和功能恢复。
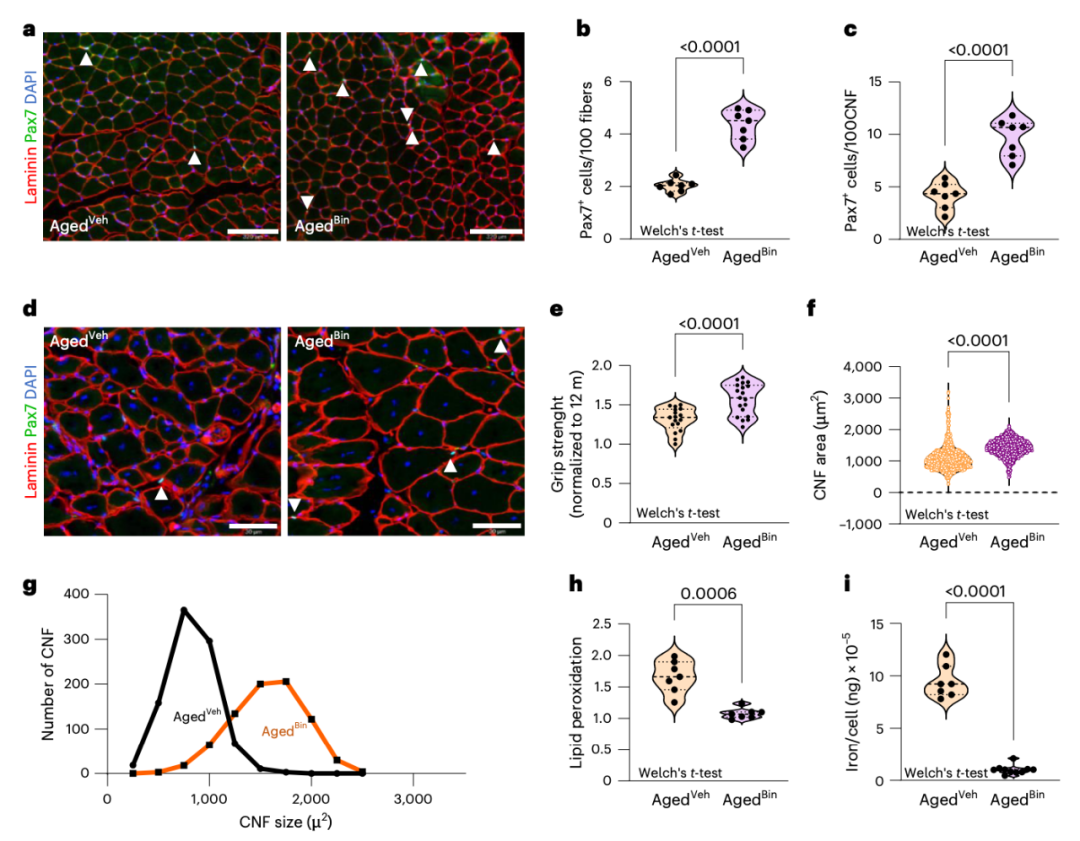
长期抑制炎症可使骨骼肌恢复活力,促进功能恢复
总的来说,这些发现揭示了一种表观遗传开关,它将慢性炎症与肌肉干细胞衰老和铁死亡联系起来,为对抗年龄相关肌肉退化提供了潜在治疗策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


