《自然》:低蛋白饮食抗癌的机制,找到了!科学家首次发现一条新型先天免疫抗癌通路
来源:奇点糕 2023-07-10 17:53
纪念斯隆-凯特琳癌症中心Li Ming团队
纪念斯隆-凯特琳癌症中心Li Ming团队近日发表在《自然》杂志上的一项研究成果[1],有点儿出人意料。
他们发现蛋白质摄入水平的变化,会重编程肿瘤相关巨噬细胞(TAMs),并改变TAMs和癌细胞之间的竞争形式。
具体来说,在正常饮食条件下,癌基因MYC过表达的乳腺癌细胞会处于竞争胜利者状态,它们会通过竞争导致MYC低表达乳腺癌细胞死亡,并吸收死亡癌细胞释放的营养物质,促进自身的生长。
让人吃惊的是,一旦切换到低蛋白饮食条件下,MYC过表达的癌细胞就变成了竞争失败者,而竞争胜利者竟然是TAMs。更神奇的是,作为竞争胜利者,TAMs不会帮助肿瘤的发展,而是变成了“好人”,直接吞噬因竞争失败而凋亡的癌细胞,最终达到控制肿瘤生长的效果。
Li博士团队详细揭示了这一现象背后的分子机制,发现了一条全新的先天免疫抗癌通路,有望催生新型抗癌免疫疗法。

论文首页截图
作为免疫学家,Li博士注意到,有些研究已经发现,在恶性肿瘤中,MYC高表达(MYChi)的癌细胞经常与MYC低表达(MYClo)的垂死癌细胞相邻[2]。
他认为,这种现象表明MYC介导的细胞竞争可能定义了肿瘤中社会细胞行为的模式。因此,他想知道其他致癌途径如何促进MYC过表达癌细胞的超级竞争者地位,以及宿主因素是否调节MYC介导的癌细胞竞争。
为了解决上述问题,Li博士团队先构建了两个乳腺癌小鼠模型:由PyMT驱动(可激活PI3K)的小鼠模型(PyMT小鼠),以及能表达MYC的PyMT小鼠模型(MYC-PyMT小鼠)。
之所以选择PyMT驱动的乳腺癌小鼠模型作为研究对象,是因为与其他基因型的乳腺癌相比,存在MYC扩增与PIK3CA基因功能增益突变的乳腺癌患者无复发生存期最短。因此,以PyMT小鼠模型作为研究对象,有望未这种难治的乳腺癌找到更好的治疗方法。
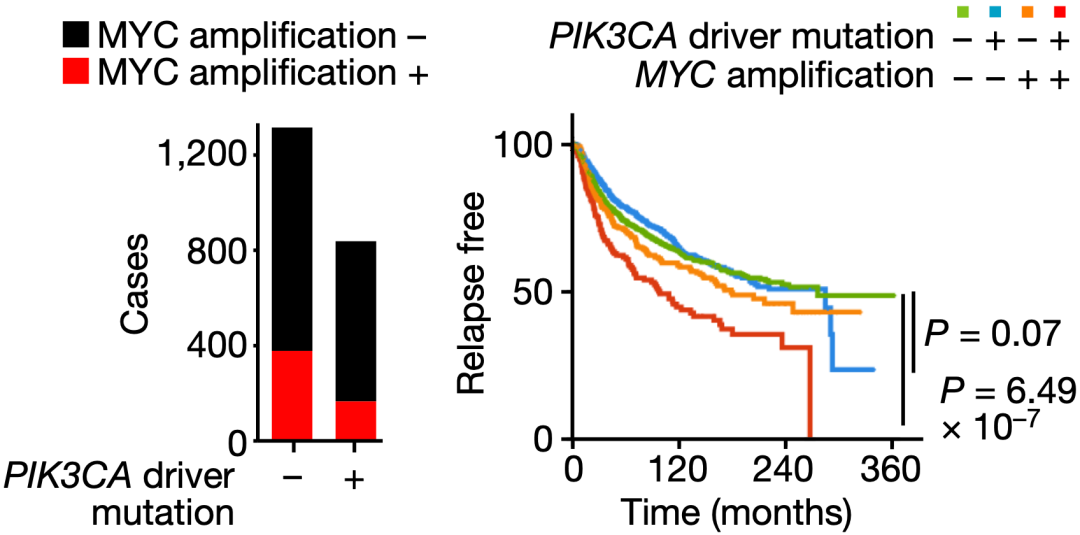
MYC扩增和PIK3CA突变驱动的乳腺癌预后不太好
基于上述两种小鼠模型,他们初步研究发现,与PyMT小鼠相比,MYC-PyMT小鼠肿瘤发生的更早和生长的更快。
与之前的研究类似,他们也在MYC高表达癌细胞附近发现了凋亡的MYC低表达的癌细胞,这意味着MYC-PyMT肿瘤中发生了MYC介导的癌细胞竞争。此外,MYC-PyMT小鼠的竞争赢家MYC高表达癌细胞代谢活跃,细胞体积大,而且这些现象与mTORC1过度激活有关。
基于以上研究结果,Li博士团队推测,mTORC1信号在促进MYC-PyMT小鼠中MYC高表达癌细胞的竞争能力方面起着至关重要的作用。
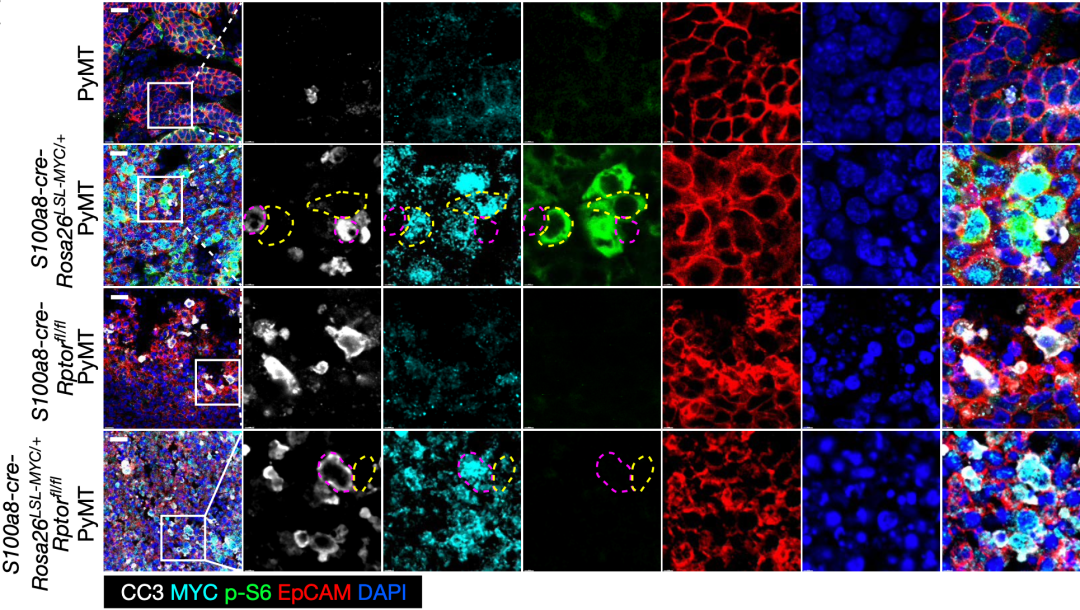
MYC-PyMT肿瘤中发生了MYC介导的癌细胞竞争
为了证实上述推测,Li博士团队给PyMT和MYC-PyMT肿瘤进行了RNA测序。
测序结果表明,MYC-PyMT肿瘤的基因表达方案很独特,支持氨基酸代谢和氨基酸tRNA生物合成的基因表达较高,但促进细胞合作行为的基因表达较低。值得一提的是,这些特征与具有MYC扩增和PIK3CA功能增益突变的人类乳腺肿瘤相同,这说明小鼠模型很好地反应了此类肿瘤的分子特征。
需要注意的是,在MYC-PyMT肿瘤中与细胞对饥饿的反应有关的RNA也大量富集。他们认为这意味着MYC-PyMT癌细胞为了生存,需要获取大量氨基酸等营养物质。
这个现象让Li博士团队想到:癌细胞之间的竞争有可能受到饮食中的氨基酸调节。于是他们给小鼠准备了两种饮食方案:蛋白质含量为15%的正常饮食方案(NP)和蛋白质含量为2%但等热量低蛋白饮食方案(LP)。
随后,他们让肿瘤负担相匹配的MYC-PyMT小鼠和PyMT小鼠分别摄入这两种食物。喂养结果显示,与NP饮食相比,LP饮食选择性地抑制了MYC-PyMT小鼠的肿瘤生长,而不是影响PyMT小鼠的肿瘤生长。
出人意料的是,当他们仔细研究肿瘤微环境时,发现在NP饮食条件下,MYC-PyMT肿瘤中的巨噬细胞居然被耗尽了,但在LP饮食处理的MYC-PyMT肿瘤中,却出现了一群mTORC1活性高的TAMs。而且,与mTORC1过度激活癌细胞一样,mTORC1活性高的TAMs的细胞体积也更大。
这些发现说明,NP和LP饮食对MYC-PyMT小鼠的癌细胞和TAMs的mTORC1活性有相反的调节作用,而且mTORC1的过度激活同样也与TAMs的生长和扩张有关。
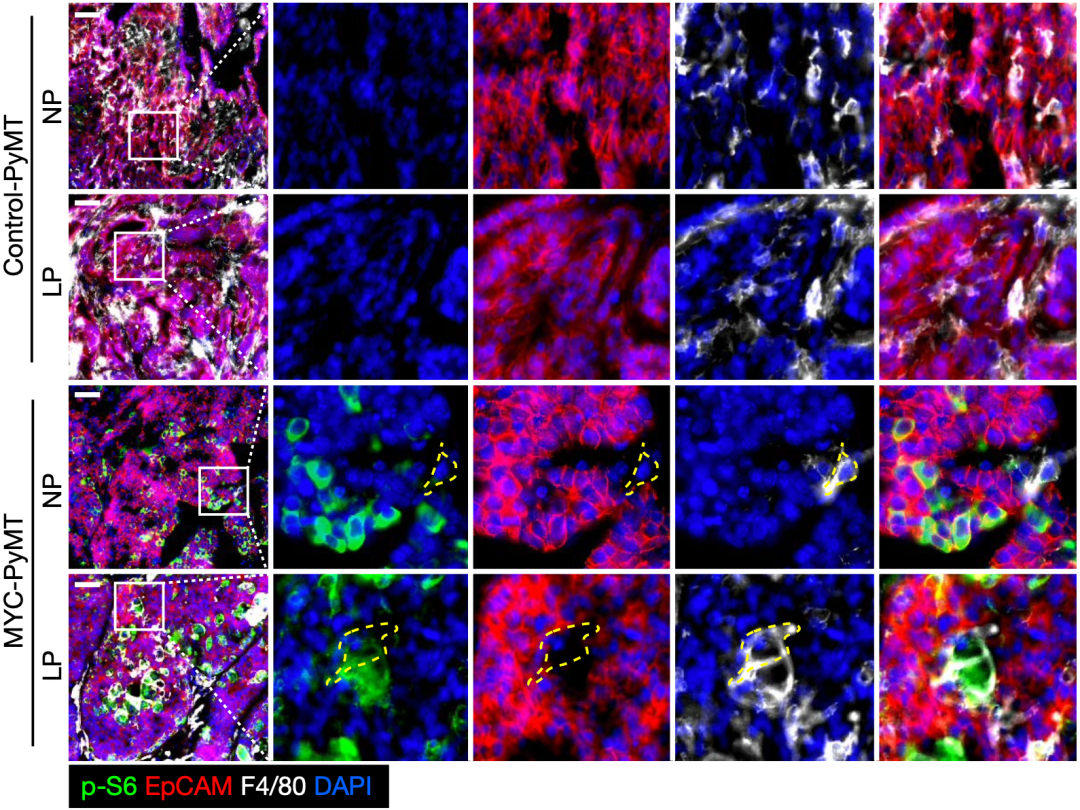
NP和LP饮食对TAMs的影响
巨噬细胞的出现,以及不同营养状态对巨噬细胞活性的影响,让这个研究变得有意思起来。接下来要研究的问题显然是营养状态的变化究竟是如何影响巨噬细胞的。
Li博士团队的研究结果表明,在巨噬细胞的溶酶体膜上有一套复杂而精密的氨基酸感知系统。简单来说,当细胞内氨基酸水平高的时候,会被GATOR1感知,这个系统就会将转录因子TFEB/TFE3招募到溶酶体上,导致转录因子无法进入细胞核,mTORC1信号水平就会降低,巨噬细胞就处于竞争劣势地位;当巨噬细胞内氨基酸水平较低时,会被另一个叫做FLCN的蛋白感知,它会让系统释放TFEB/TFE3,转录因子顺利进入细胞核,增强mTORC1信号水平,让巨噬细胞处于竞争的优势地位。
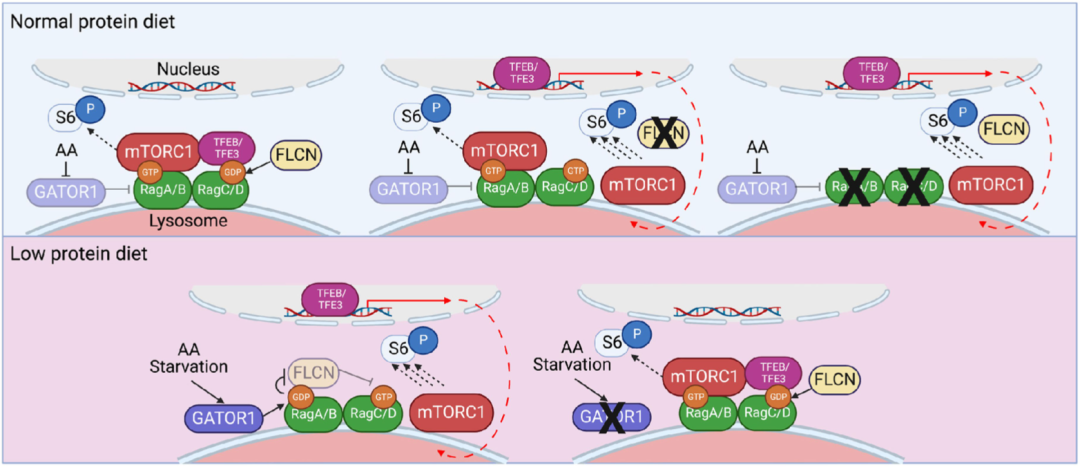
调控机制示意图
后续的研究还发现,在低蛋白饮食(LP)条件下,MYC-PyMT肿瘤内的巨噬细胞吞噬能力也增强了,而且正是巨噬细胞的这种吞噬功能驱动了mTORC1的激活,以及巨噬细胞的生长/增殖和抗肿瘤作用。
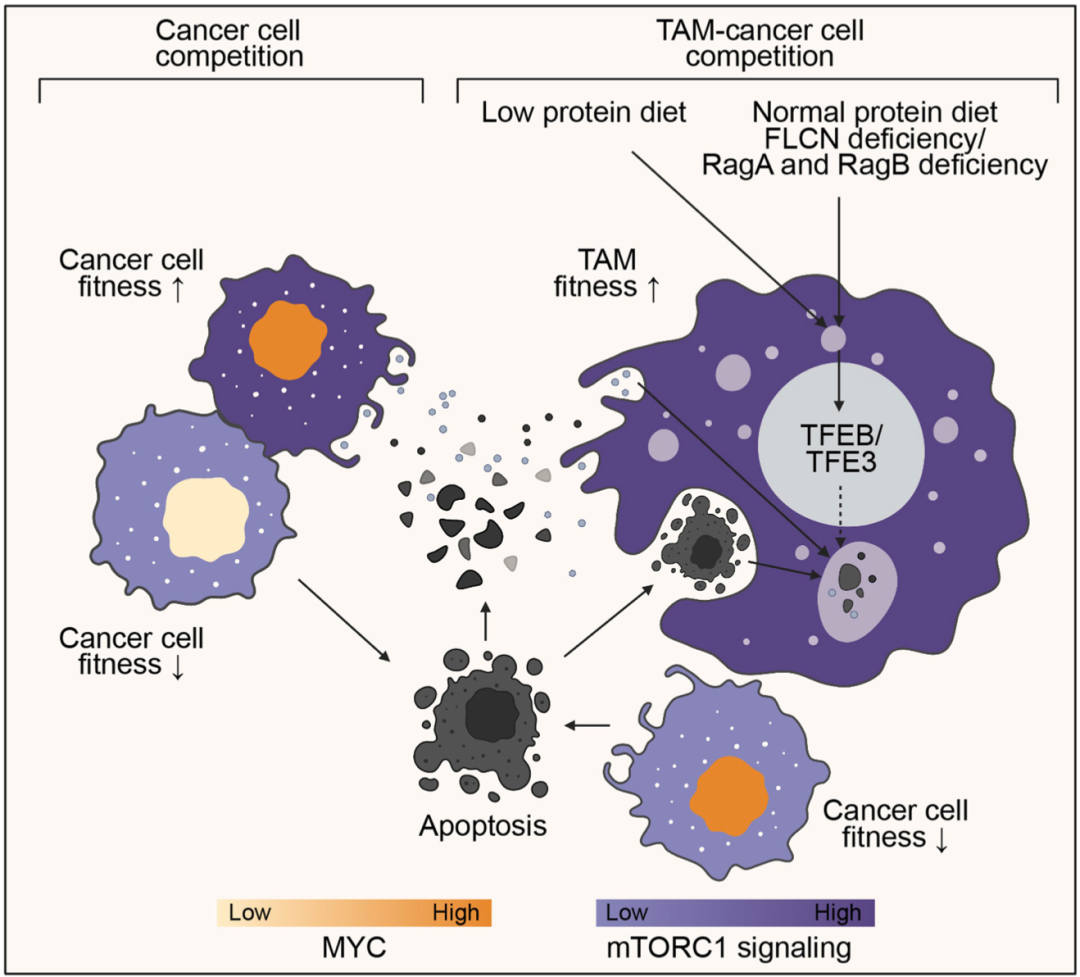
氨基酸影响对竞争影响的示意图
总的来说,Li博士团队揭示了营养对癌细胞和巨噬细胞之间竞争的影响,在一定程度上揭示了低蛋白饮食抗癌的机制。
最重要的是,这个研究发现了一个新型的先天免疫细胞抗癌机制,可以将肿瘤相关巨噬细胞转变成抗癌利器,这无疑为基于巨噬细胞的新型癌症免疫治疗提供了新靶点。
当然啦这个研究还留下了一些疑问,例如LP饮食对癌细胞和巨噬细胞不同影响的机制是什么等等。这些问题的解答有助于促进我们对低蛋白饮食抗癌机制的认知,或许还能发现新的抗癌靶点。
参考文献:
[1].Zhang X, Li S, Malik I, et al. Reprogramming tumour-associated macrophages to outcompete cancer cells. Nature. 2023. doi:10.1038/s41586-023-06256-5
[2].Di Giacomo S, Sollazzo M, de Biase D, et al. Human Cancer Cells Signal Their Competitive Fitness Through MYC Activity. Sci Rep. 2017;7(1):12568. doi:10.1038/s41598-017-13002-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


