Nat Commun:突破!东京大学利用干细胞和类器官技术重现胆管发育,开启胆汁淤积性疾病治疗新纪元
来源:生物谷原创 2024-09-04 13:12
本研究成功模拟了肝上皮组织与血管的相互作用,形成了含有人工血管的肝类器官(BVLO),重建了人类胆管结构,为研究先天性胆道疾病提供了一个有效的体外模型。
胆管(bile ducts,BD)在肝脏门静脉周围特异性发育,负责将肝细胞分泌的胆汁输送到肠道。胆管细胞是肝内胆管(intrahepatic bile ducts,IHBD)的上皮成分,由肝母细胞分化而来。IHBD的结构功能障碍会阻止胆汁排泄并导致胆汁淤积,引发严重的肝损伤。血管与胆管(BV-BD)之间的相互作用对IHBD的发育至关重要。
近日,东京大学Hideki Taniguchi研究团队在Nat Commun发表了题为Generation of human iPSC-derived 3D bile duct within liver organoid by incorporating human iPSC-derived blood vessel的研究性论文。研究团队通过共培养人类诱导多能干细胞(hiPSC)生成的肝祖细胞和人工血管,成功模拟了肝上皮组织与血管间的相互作用,构建了含有人工血管的肝类器官(BVLO),重建了人类胆管结构,为研究先天性胆道疾病提供了一个有效的体外模型。

研究表明,门静脉的血管平滑肌细胞(PV-SMCs)与胆管细胞的早期分化相关。胆管细胞的分化高度依赖于门静脉(PV),PV-SMCs在胆管发育中具有重要作用。敲除Notch配体Jagged1(JAG1)会导致胆管发育异常。
本研究通过对小鼠和人类胎肝进行免疫染色分析发现,PV-SMCs在肝门区表达高水平的αSMA,而在外围区域则主要表达SM22和低水平的αSMA。外围区域的未成熟平滑肌细胞(imSMCs)与胆管细胞的早期分化相关,JAG1在这些未成熟细胞中表达较高。上述结果表明,PV-SMCs的未成熟状态与胆管发育的早期阶段密切相关。
为探讨不同成熟阶段的hiPSC-SMCs对双能肝祖细胞向胆管细胞分化的影响,研究人员从人类诱导多能干细胞(hiPSC)中诱导出血管平滑肌细胞(SMCs)。免疫荧光和定量PCR(qPCR)数据显示,在hiPSC-SMC的分化过程中,SM22+αSMAlow细胞在分化的第6天出现,而SM22+αSMAhigh细胞在第10天出现。
研究人员将第6天和第10天出现的间充质细胞分别称为hiPSC-imSMCs和hiPSC-SMCs,qPCR分析显示,JAG1在hiPSC-imSMCs中高表达,提示未成熟的SMCs(imSMCs)可能具有更高的诱导胆管细胞分化的潜力。
接着,研究人员通过建立3D共培养系统,将含有JAG1、TGFβ1和Laminin 511的人类诱导多能干细胞(hiPSC)血管与肝类器官结合,成功诱导出胆管样结构。胆管细胞在三周培养期内分化,形成了具有典型胆管标志物和结构特征的胆管样结构。该系统有效地模拟了胆管细胞的分化过程,验证了其作为研究胆管发育模型的潜力。
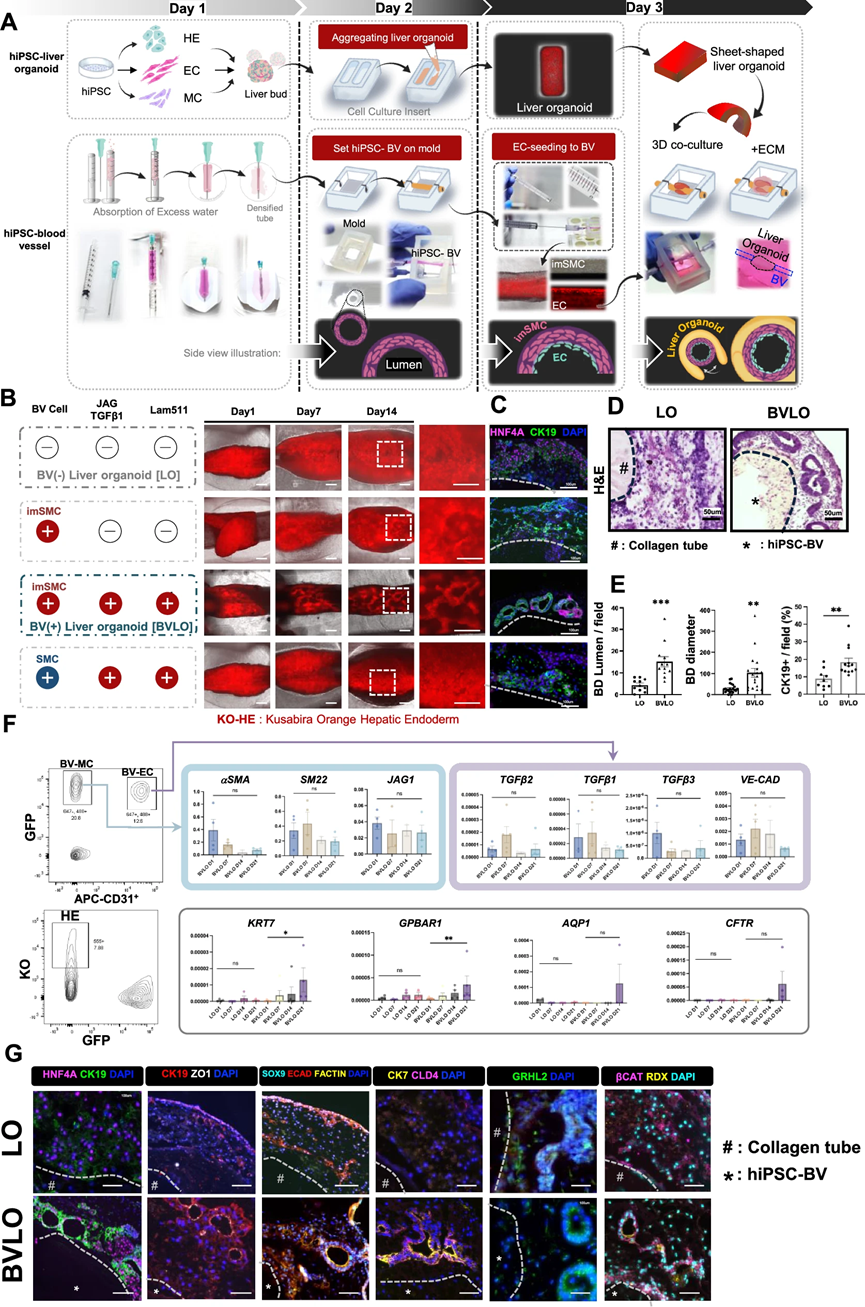
图1:优化的人iPSC来源血管在hiPSC血管掺入的肝类器官(BVLO)中诱导管状胆管结构
研究人员对含有血管的肝类器官(BVLO)中生成的hiPSC-胆管进行了结构和功能分析。他们发现这些胆管形成了管状结构,并具有紧密连接和微绒毛等典型的胆管上皮细胞特征。此外,这些胆管表现出了依赖多药耐药蛋白1(MDR1)的排泄和分泌功能。研究人员还检测到了γ-谷氨酰转移酶(GGT)和碱性磷酸酶(ALP)的活性,这进一步证实了hiPSC-胆管的功能性。总的来说,BVLO中的hiPSC-胆管成功再现了真实胆管的结构和功能。
当将来源于人诱导多能干细胞(hiPSC)的肝祖细胞移植到免疫缺陷小鼠的肝脏表面时,研究人员观察到移植后的胆管细胞在其顶端表面表达了OPN和乙酰化微管蛋白。这些标志物在体外培养环境中并未出现,表明这些细胞在体内环境中进一步成熟了。
为了验证移植的胆管细胞是否与宿主的胆管系统相连,研究人员向移植了胆管的小鼠肝组织中注射了碳墨水,并进行了免疫荧光分析。结果证实,移植的胆管细胞确实与宿主的肝内胆管建立了连接。这表明体内环境不仅促进了胆管细胞的高度成熟,而且还帮助它们与宿主的胆管系统形成了功能性连接。

图2:BVLO体外和体内功能表征
为进一步研究BVLO移植对胆汁淤积性疾病的作用,研究人员在免疫缺陷小鼠中通过胆管结扎(BDL)诱导胆汁淤积性肝损伤,然后将BVLO移植到小鼠肝脏表面。结果显示,移植后的小鼠存活时间显著延长,胆红素水平降低,体重减轻程度减轻。分析显示,移植的胆管结构腔体变大,推测BVLO与宿主胆管的连接可能为受体肝脏提供了一个辅助的胆汁储存空间,从而暂时缓解了胆汁淤积的症状。
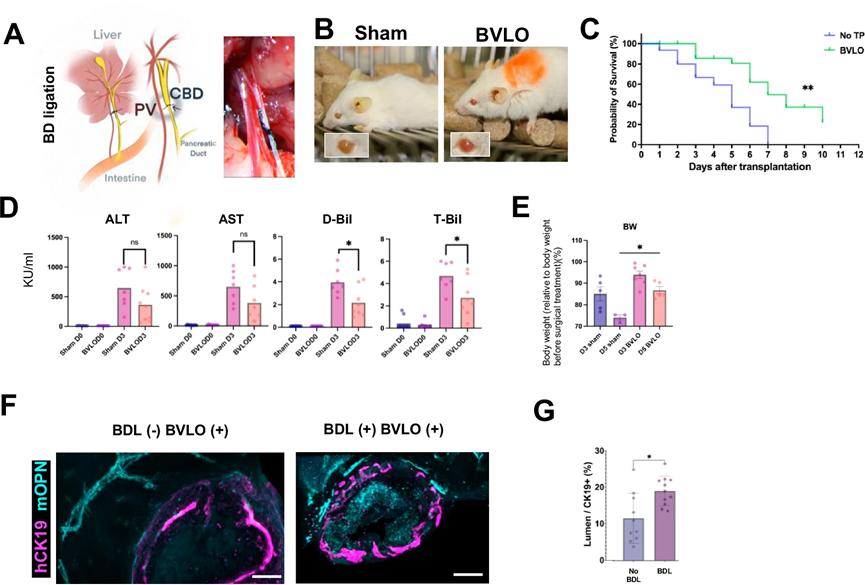
图3:BVLO肝表面移植后胆管结扎小鼠模型的存活率暂时提高
最后,通过单细胞RNA测序分析BVLO(胆管和血管类肝脏类器官)中的细胞组分,研究人员发现TGFβ和Notch信号通路在胆管和血管的相互作用中发挥关键作用。
结果显示,BVLO中的细胞与人类成人肝脏细胞相似,特别是在肝细胞和胆管细胞的亚群划分上,说明TGFβ信号在内皮细胞-胆管细胞和间充质细胞-胆管细胞的相互作用中最为显著,而JAG1-NOTCH信号则主要在间充质细胞-胆管细胞的相互作用中激活。

图4:BVLO中的PV-BD相互作用
总体而言,本研究通过模拟胎儿肝脏发育中的门静脉-胆管相互作用,在hiPSC肝脏类器官中成功生成了胆管结构。研究表明,未成熟的平滑肌细胞(SMCs)在胆管发育的初期发挥了关键作用,而人工血管的引入有助于胆管腔的形成。移植后的胆管结构显示出成熟的表型标志,但仍需进一步优化以实现完全成熟。该方法有效模拟了胆管发育异常,为研究先天性胆道疾病提供了一个有效的体外模型。(生物谷Bioon.com)
参考文献:
Carolina, E., Kuse, Y., Okumura, A. et al. Generation of human iPSC-derived 3D bile duct within liver organoid by incorporating human iPSC-derived blood vessel. Nat Commun 15, 7424 (2024). https://doi.org/10.1038/s41467-024-51487-3
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


