EMBO J:范祖森团队等揭示circRNA负向调控肠道干细胞自我更新的新机制
来源:生物世界 2023-02-09 11:38
该研究揭示了非编码RNA circBtnl1负向调控肠道干细胞自我更新的新机制,发现了Atf4/Sox9信号参与干性稳态维持的新功能,为解析肠道干细胞的稳态调控机制提供了新视角。
肠道是体内最大的消化吸收器官和外周免疫器官,主要包括肠上皮和固有层两部分。肠上皮的所有成熟细胞均由位于隐窝底部的肠道干细胞产生,这些干细胞具有自我更新和分化能力。肠道干细胞作为肠道上皮的种子细胞,对于整个肠道上皮的更新和稳态维持至关重要。
范祖森课题组最近鉴定发现肠道上皮细胞新亚群Tuft2细胞具有抵抗病原体感染的作用,参与肠道黏膜稳态的维持(Immunity, 2022)。前期发现了长链非编码RNA lncGata6 调控肠道干细胞的自我更新(Nature Cell Biology, 2018)。发现肠道驻留ILC2 细胞分泌IL-13介导肠道干细胞高表达circPan3促进其再生能力(Nature Immunity, 2019)。还发现肠道神经细胞分泌的5-HT激活PGD2+巨噬细胞,使其产生PGE2继而激活Wnt信号通路促进肠道干细胞的干性(Cell Research, 2022)。并发现肠道神经细胞分泌的5-HT还能够激活肠癌干细胞的干性和肠癌发生,阻断5-HT信号显著抑制肠癌的发生和转移(Neuron, 2022)。
近日,中国科学院生物物理研究所范祖森课题组在 The EMBO Journal 期刊发表了题为:Noncoding RNA circBtnl1 suppresses self-renewal of intestinal stem cells via disruption of Atf4 mRNA stability 的研究论文。
该研究揭示了在肠道干细胞高表达的环状RNA-circBtnl1在稳态情况下抑制肠道干细胞的自我更新,并通过调控Atf4/Sox9信号调节干性维持的分子机制。

在该研究中,研究团队发现circBtnl1敲低能够促进肠道干细胞的增殖和类器官的生长。我们构建了circBtnl1敲除小鼠,发现circBtnl1缺失后小鼠肠道隐窝和肠绒毛明显增多,肠道干细胞的数目也显著增多。同时,circBtnl1敲除后并不影响其母基因Btnl1的mRNA和蛋白水平的表达,表明circBtnl1通过一种不依赖于Btnl1 mRNA和蛋白的方式调节肠道干细胞的自我更新能力。在稳态情况下,circBtnl1和RNA解旋酶Ddx3y竞争性结合转录因子Atf4的mRNA,进而抑制Atf4 mRNA的稳定性,继而抑制干性因子Sox9的转录表达,抑制肠道干细胞的再生能力,首次揭示circBtnl1对肠道稳态的负性调节作用。
总之,该研究揭示了非编码RNA circBtnl1负向调控肠道干细胞自我更新的新机制,发现了Atf4/Sox9信号参与干性稳态维持的新功能,为解析肠道干细胞的稳态调控机制提供了新视角。
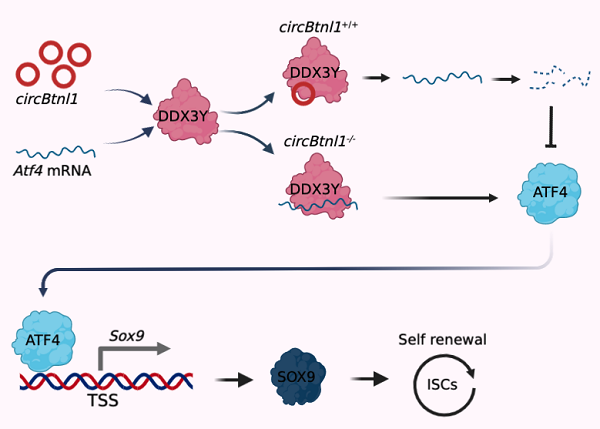
circBtnl1负向调控肠道干细胞自我更新的分子机制
中国科学院生物物理研究所范祖森研究员、田勇研究员和郑州大学朱平平研究员为论文共同通讯作者,中国科学院生物物理研究所助理研究员郭晖和博士研究生张嘉航为并列第一作者。该研究得到了科技部重点研发计划、国家自然科学基金和中科院先导专项等经费支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


