《细胞》:修改教科书!中国科学家发现细菌感染细胞全新模式,哪里“紧张”去哪里
来源:代丝雨 2025-05-13 09:55
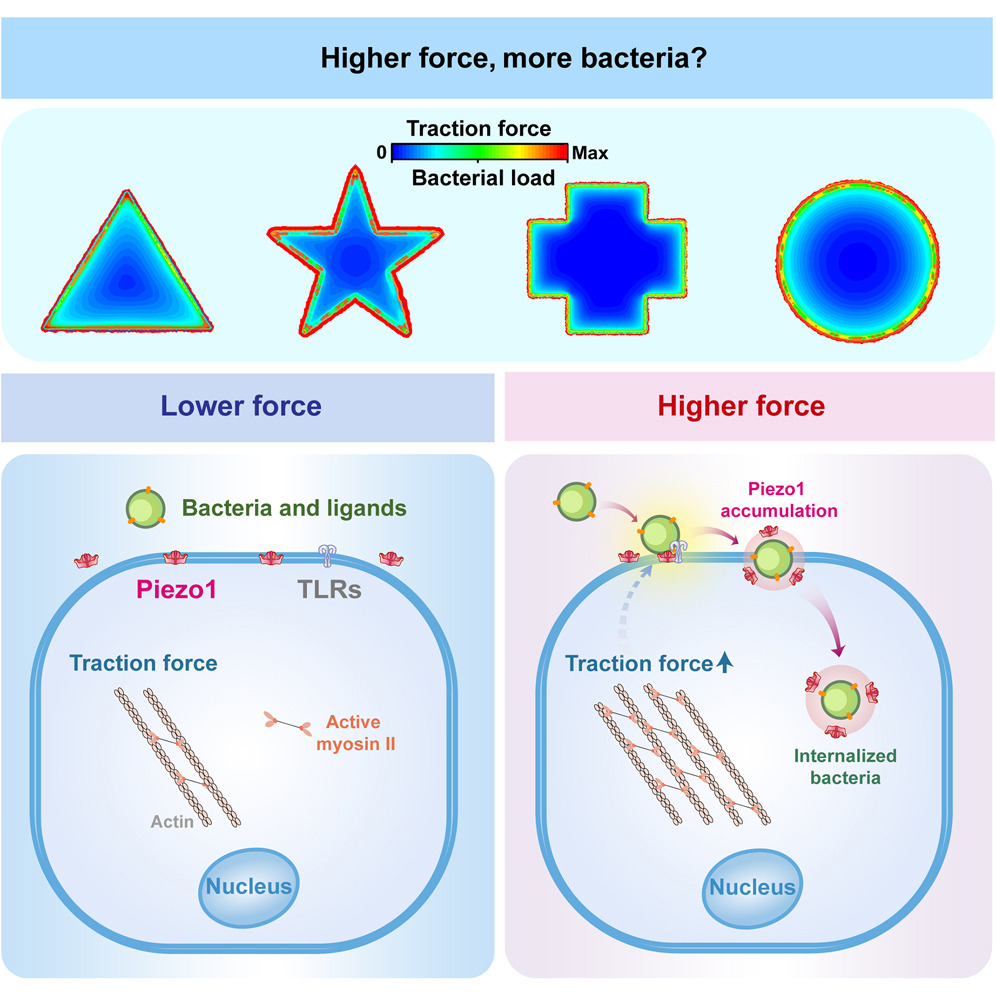
研究发现,细菌感染上皮组织的时候并不是随机分布的,而是明显倾向于感染组织中细胞牵引力大的区域,也就是说细菌优先感染什么部位,还会受到组织的几何形状的影响。
细菌感染是一系列动态过程,从黏上细胞、进入细胞,再到扩散到其他细胞,涉及复杂的分子过程。有趣的是,致病菌在侵入宿主细胞的时候,有着明显的“喜好”差异,长期以来的研究都观察到,致病菌更倾向于在肠道和呼吸道的隐窝样结构中定植。
这很奇怪啊,隐窝到底有什么吸引病菌的,总不能是隐窝有个坑所以菌容易存在里边儿吧?
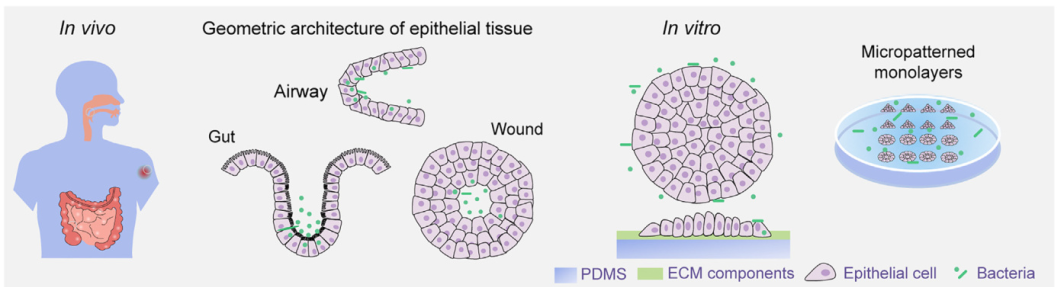
《细胞》杂志发表了来自我国科学家团队的一篇论文,研究者们发现了细菌感染宿主细胞的一种全新模式。研究发现,细菌感染上皮组织的时候并不是随机分布的,而是明显倾向于感染组织中细胞牵引力大的区域,也就是说细菌优先感染什么部位,还会受到组织的几何形状的影响。
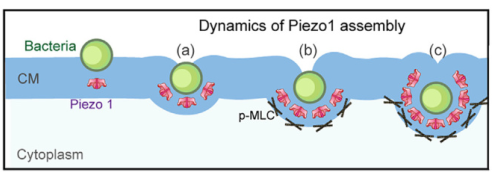
实验结果显示,经典力敏感离子通道蛋白Piezo1会在高牵引力区域富集并显著激活,形成外囊泡帮助细菌进入细胞。而这一机制也可以被我们反向利用,增加细菌感染部位的局部抗生素浓度,更有效地杀死致病菌。
该研究通讯作者为中国农业大学朱奎、北京大学黄建永、中国科学院深圳先进技术研究院黄术强。

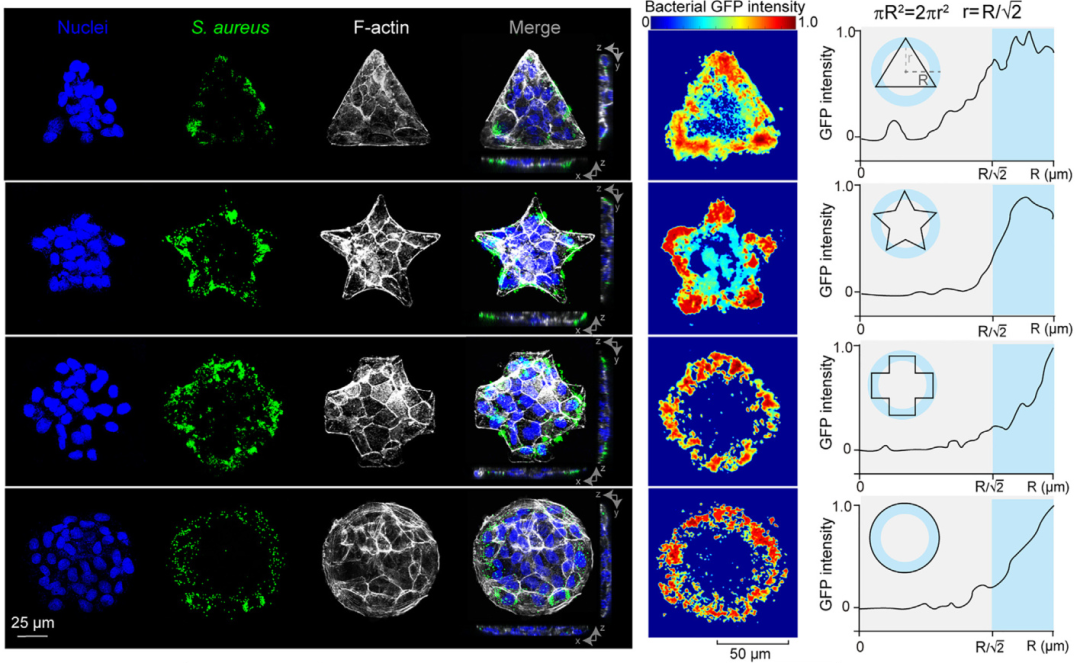
用不同细胞打底,又测试了其他知名致病菌,比如耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素肠球菌(VRE)等等,都出现了类似的细菌感染模式。
为什么细菌会对图形边缘独有偏好?
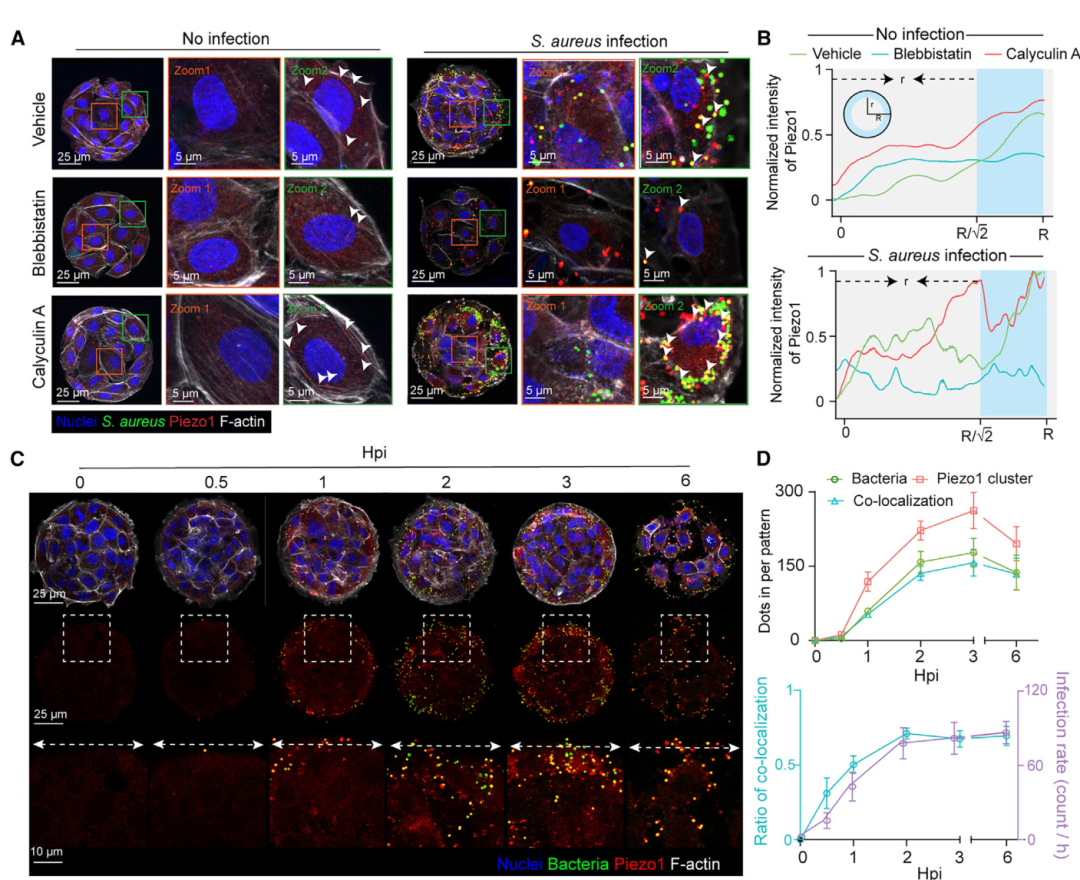
研究者分析发现,细胞层图形边缘附近的细胞牵引力更强,相应的,产生牵引力的肌球蛋白II水平也更高。研究者分别用肌球蛋白II的拮抗剂和激动剂去处理细胞,发现拮抗后细菌就不再偏好图形边缘了。
研究者一下就想到了Piezo1蛋白,这是一种著名的机械敏感离子通道蛋白,可以响应机械力转导产生胞内生物信号。这个功能对细胞来说非常重要,比如说,细菌脂多糖(LPS)就会上调侵袭部位Piezo1和toll样受体4(TLR4)的组装,从而重塑肌动蛋白、增强巨噬细胞的吞噬作用。
实验结果发现,Piezo1明显和细菌共定位,而且它在细胞层图形边缘的富集受肌动蛋白II的调控,拮抗肌动蛋白II会减少Piezo1在边缘的富集,激活肌动蛋白II则会增加其富集。
研究者在能更好地模拟肠道三维环境的肠道新片上测试了细菌的感染行为。实验结果显示,超过70%的各种病原菌会定植在隐窝样结构中。
既然病菌自己聚团了,咱们是不是也能定点打击呢?
研究者测试了载药纳米粒子(NPs)递送利奈唑胺(LZD),实验结果显示大约60%的NPs会被准确递送到隐窝样结构中,由于局部抗生素浓度增加,抗菌显著提升。
研究者在小鼠的肠道VRE感染模型中进一步测试了NPs策略的可行性。在没有治疗的情况下,大量VRE会积聚在类似隐窝的结构中。
相较普通的利奈唑胺处理,NPs递送的抗菌效果显然好得多,治疗后病原菌载荷仅剩1%,相应的由感染导致的组织损伤也好转了很多。
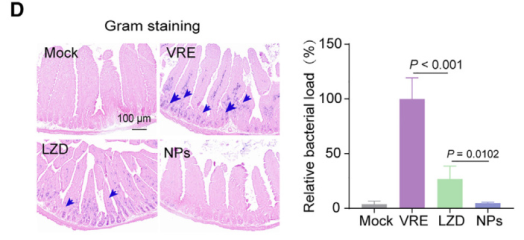
这可真是厉害,精确打击了病原菌聚集地,局部提升抗生素浓度,既能够增强疗效,又有助于减轻毒副作用,可谓一举两得了。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


