当铁死亡遇上纳米“诱饵”?PNAS:纳米颗粒双重出击,直击耐药癌细胞代谢软肋
来源:生物谷原创 2025-06-12 11:43
来自美国西北大学医学院等机构的科学家们通过研究开发了一种利用癌细胞隐藏的代谢脆弱性来杀死耐药性癌细胞的有前景的方法。
癌症,这个令人闻风丧胆的健康杀手,始终是医学界亟待攻克的堡垒。尽管手术、放化疗及靶向治疗等手段不断革新,部分癌细胞却凭借强大的耐药性和独特的代谢适应性,成为难以根除的 "顽固分子"。近年来,一种名为铁死亡(Ferroptosis)的新型细胞死亡机制,因其依赖铁离子介导的脂质氧化特性,为破解耐药癌症困境带来了曙光。
2025 年 5 月 30 日,美国西北大学医学院团队在《美国国家科学院院刊》(PNAS)发表的最新研究,更是突破性地揭示了一种利用双重代谢打击诱导铁死亡的抗癌新策略。

铁死亡
铁死亡是区别于凋亡、坏死的独特细胞死亡方式,其核心是铁离子催化细胞膜多不饱和脂肪酸(PUFA)发生过氧化反应,导致膜结构破坏。耐药癌细胞往往依赖谷胱甘肽过氧化物酶 4(GPx4)这一关键抗氧化酶维持生存 ——GPx4 能将脂质过氧化物还原为无害物质,而其合成高度依赖硒元素参与的特殊氨基酸(硒代半胱氨酸)。因此,削弱 GPx4 功能成为诱导铁死亡的核心靶点。
研究亮点:一箭双雕的纳米 "诱饵"
研究团队开发的合成高密度脂蛋白样纳米颗粒(HDL NP),犹如一枚精准制导的 "生物导弹":其表面模拟天然高密度脂蛋白(HDL),靶向癌细胞表面高表达的SR-B1 受体,不仅能阻断胆固醇摄取破坏膜稳定性,更能启动双重代谢攻击:
切断硒供给,瓦解抗氧化防线:HDL NP 通过下调 TXNRD1 基因,减少细胞对硒的利用,导致 GPx4 等硒蛋白合成锐减,解除癌细胞的 "抗氧化盾牌"。
激活脂质氧化,点燃死亡导火索:依赖 ACSL4 基因催化合成的 PUFA 膜磷脂,为铁死亡提供关键底物,HDL NP 通过强化这一过程,加速脂质过氧化反应。
关键实验流程:
1. 全基因组筛选:利用 CRISPR-Cas9 技术,在卵巢透明细胞癌(OCCC)细胞系中筛选 3000 个代谢相关基因,发现ACSL4和TXNRD1缺失可使癌细胞抵抗 HDL NP 诱导的死亡。
2. 功能验证:
ACSL4:负责激活 PUFA 并入膜,其缺失导致脂质过氧化底物不足,癌细胞对 HDL NP 耐药。
TXNRD1:调控硒代半胱氨酸合成,其缺失使 GPx4 表达升高,恢复抗氧化能力。
3. 机制解析:HDL NP 通过 SR-B1 受体进入细胞后,降低细胞内硒水平,优先抑制 GPx4 合成,同时促进 ACSL4 依赖的膜磷脂过氧化,形成 "抗氧化能力下降 - 氧化损伤加剧" 的恶性循环。
核心实验证据:
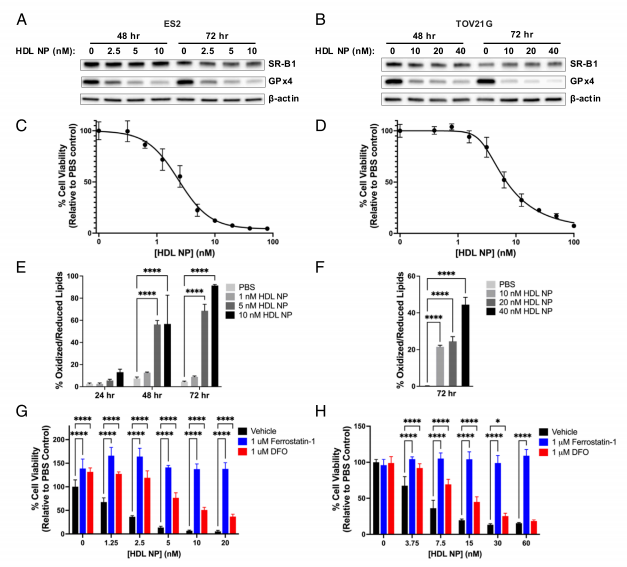
GPx4 蛋白显著减少:Western blot 显示,HDL NP 处理 48 小时后,癌细胞中 GPx4 水平随药物浓度升高而递减(图 1A/B)。
脂质过氧化飙升:C11-BODIPY 荧光探针检测显示,细胞膜脂质氧化程度呈剂量依赖性增加(图 1E/F),铁死亡抑制剂(Ferrostatin-1)可显著逆转这一过程(图 1G/H)。
硒水平直接关联:ICP-MS 检测证实,HDL NP 处理 24 小时后,细胞内硒含量下降约 30%,而补充亚硒酸钠可恢复 GPx4 表达并挽救癌细胞死亡(图 5G/H)。
图:HDL NP减少GPx4并诱导OCCC细胞中的铁凋亡
三大创新突破:
-
靶向递送系统:HDL NP 模拟天然脂蛋白,通过 SR-B1 受体精准富集于高胆固醇依赖的癌细胞(如透明细胞癌),减少对正常细胞的损伤。
-
双重机制协同:同时打击硒代谢(抑制 GPx4)和脂质代谢(促进 PUFA 过氧化),避免单一靶点耐药性,实验显示联合敲除 ACSL4+TXNRD1 的癌细胞存活率比单敲除提升 40%。
-
线粒体 "助攻":HDL NP 诱导的硒缺乏不仅影响细胞膜,还导致线粒体 ROS(活性氧)爆发式增长(图 6A-C),从细胞器层面加剧氧化应激,形成多部位协同杀伤。
与现有疗法对比:
|
治疗策略
|
作用靶点
|
优势
|
局限
|
|
HDL NP
|
SR-B1 介导双代谢通路
|
靶向性强、多机制协同、可克服 GPx4 抑制剂耐药
|
临床前研究阶段,需优化纳米颗粒生物相容性
|
|
传统化疗
|
DNA/RNA 合成
|
广谱杀伤
|
耐药性高、副作用显著
|
|
小分子 GPx4 抑制剂
|
GPx4 活性中心
|
直接抑制抗氧化酶
|
特异性不足,易引发全身硒代谢紊乱
|
从实验室到临床的 "最后一公里"
这项研究首次揭示了"硒代谢 - 脂质氧化" 双轴调控铁死亡的分子机制,为开发新型抗癌药物提供了清晰的靶点。尽管目前 HDL NP 仍处于临床前阶段,但其展现出的三大潜力令人期待:
-
精准靶向耐药亚型:针对依赖 SR-B1 和高硒需求的癌症(如卵巢透明细胞癌、肾透明细胞癌),可设计个性化纳米药物。
-
联合治疗增效:与放疗、免疫检查点抑制剂联用,通过增强氧化应激激活 "原位疫苗" 效应,可能突破免疫治疗耐药瓶颈。
-
低毒副作用:利用天然脂蛋白代谢通路,减少对正常组织的硒剥夺和氧化损伤,安全性优于传统化疗。
这项研究不仅为耐药癌症治疗提供了新武器,更揭示了癌细胞代谢脆弱性的深层机制,随着铁死亡研究的持续升温,我们有理由期待,更多像 HDL NP 这样的 "双重打击" 策略将从实验室走向临床,为癌症患者点燃新的希望。(生物谷Bioon.com)
参考文献:
Sophia M. Lamperis,Kaylin M. McMahon,Andrea E. Calvert, et al. CRISPR screen reveals a simultaneous targeted mechanism to reduce cancer cell selenium and increase lipid oxidation to induce ferroptosis, Proceedings of the National Academy of Sciences (2025). DOI:10.1073/pnas.2502876122.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。