《癌症通讯》:南方医院团队揭示促癌巨噬细胞在肠癌肝转移灶“集结”之谜,有望为肠癌肝转移免疫治疗“破局”!
来源:奇点糕 2025-08-02 18:23
研究揭示了一个阻碍CRLM免疫治疗的“幕后黑手”——肿瘤相关巨噬细胞(TAMs)中的鞘氨醇激酶1(SPHK1)。
肝脏是结直肠癌远处转移的最主要靶器官,结直肠癌肝转移(CRLM)一直是结直肠癌治疗的重点和难点。
近年来,免疫检查点抑制剂(ICIs)为癌症治疗带来突破,可它在CRLM患者中的疗效,却因为肿瘤微环境(TME)的免疫抑制特性而大打折扣[1]。
近期,南方医科大学南方医院方媛、沈智勇的研究团队在Cancer Communications期刊发表的研究成果[2],揭示了一个阻碍CRLM免疫治疗的“幕后黑手”——肿瘤相关巨噬细胞(TAMs)中的鞘氨醇激酶1(SPHK1)。谁能想到,这个在鞘脂代谢中起关键作用的激酶,竟然会在CRLM的免疫抑制微环境中扮演如此重要的角色。
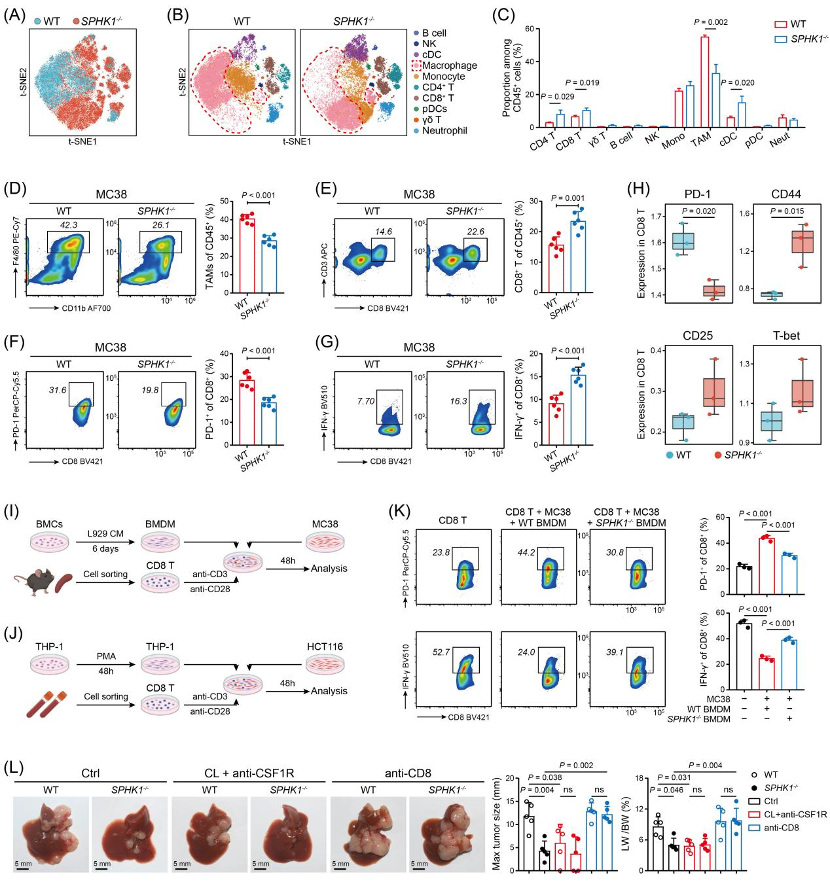
这其实是SPHK1+ TAMs与结直肠癌细胞联手制造的阴谋:SPHK1+ TAMs通过自身产生的鞘氨醇-1-磷酸(S1P),以自分泌的方式激活NLRP3炎症小体,释放IL-1β;而IL-1β又会作用于结直肠癌细胞,使其上调单核细胞趋化因子和ADAM17的表达,进而导致更多TAMs浸润,并引发CD8+ T细胞功能障碍,形成一个恶性循环。

论文首页截图
从既往研究来看,SPHK1并非“安分守己”之辈,它在多种癌症的发展过程中都有涉足,比如在黑色素瘤中就被发现能通过MTA3-PD-L1轴抑制抗肿瘤免疫来促进肿瘤生长[3]。研究者们首次将SPHK1与TAMs在CRLM中的免疫抑制作用联系起来,并明确其对免疫治疗效果的影响。
对CRLM患者组织样本的分析显示,SPHK1主要在TAMs中高表达,且SPHK1+ TAMs的浸润水平与患者的不良预后以及免疫治疗效果不佳相关。这一现象在动物模型中也得到了验证,敲除SPHK1或使用SPHK1抑制剂后,小鼠肝转移灶的数量和大小明显减少,生存期显著延长,同时TME中TAMs数量明显减少,CD8+ T细胞的耗竭状态得到改善,效应功能增强。将TAMs、CD8+ T细胞和结直肠癌细胞三者进行共培养,证实了TAMs中SPHK1对CD8+ T细胞具有显著的免疫抑制效应。
靶向巨噬细胞中的SPHK1可改善CD8+ T细胞效应功能,逆转CRLM的免疫抑制性微环境
研究者们进一步发现SPHK1催化产生的S1P与TAMs表面的S1PR2结合,通过激活NF-κB和HIF-1α信号通路,促进NLRP3炎症小体的激活和IL-1β的释放。IL-1β一方面会诱导结直肠癌细胞分泌更多的CCL2、CCL7等单核细胞趋化因子,招募更多TAMs到微环境;另一方面会促使结直肠癌细胞释放ADAM17,ADAM17则会导致CD8+ T细胞表面CD62L的表达降低,影响其迁移和抗肿瘤活性,并上调PD-1等耗竭标志物的表达。
值得注意的是,当将SPHK1抑制剂与抗PD-1免疫治疗或放免治疗联合使用时,在小鼠模型中取得了更为显著的抗肿瘤效果,不仅肝转移得到有效抑制,小鼠的生存期也进一步延长。这提示SPHK1有望成为预测CRLM患者免疫治疗疗效的生物标志物,而针对SPHK1的治疗策略可能为提高CRLM患者的免疫治疗效果提供新的方向。

靶向SPHK1治疗增强抗PD-1免疫疗法的疗效
总而言之,该研究深入阐明了SPHK1+ TAMs在CRLM免疫抑制微环境形成中的核心作用及分子机制,提出了靶向SPHK1与抗PD-1免疫治疗的联合策略,为改善CRLM患者预后提供了极具潜力的新方向。
参考文献:
1.Yu J, Green MD, Li S, Sun Y, Journey SN, Choi JE, et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat Med. 2021;27(1):152-64.
2.Zhan Y, Xu J, Zhang Z, Hu Y, Li Y, Qian J, et al. Targeting SPHK1 in macrophages remodels the tumor microenvironment and enhances anti-PD-1 immunotherapy efficacy in colorectal cancer liver metastasis. Cancer Commun (Lond). 2025.
3.Lau P, Zhang G, Zhao S, Liang L, Zhang H, Zhou G, et al. Sphingosine kinase 1 promotes tumor immune evasion by regulating the MTA3-PD-L1 axis. Cell Mol Immunol. 2022;19(10):1153-67.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


